Fiebre reumática aguda
La FRA se caracteriza por un síndrome clínico cuyas manifestaciones más comunes son las artralgias y la carditis. Consideraciones sobre la fiebre reumática aguda, en particular su diagnóstico y manejo para médicos no especializados.Autor: Rachel Helena Webb, Cameron Grant, Anthony Harnden Fuente: BMJ 2015;351:h3443 Acute rheumatic fever
La fiebre reumática (FR) aguda (FRA) es una respuesta inflamatoria a la infección por el estreptococo grupo A, la que comúnmente ocurre 2-3 semanas después de la infección de la garganta. En todo el mundo ocurren unos 500.000 casos nuevos por año mientras que 15 millones de personas sufren cardiopatía reumática crónica. La FRA se caracteriza por un síndrome clínico cuyas manifestaciones más comunes son las artralgias y la carditis.
La carditis ocurre en casi el 80% de las personas con FR y comúnmente afecta a las válvulas mitral y aórtica provocando regurgitación. Otros cuadros clínicos menos comunes son los movimientos involuntarios anormales (corea), la erupción (eritema marginado) y los nódulos subcutáneos.
La carditis ocurre en casi el 80% de las personas con FR y comúnmente afecta a las válvulas mitral y aórtica provocando regurgitación. Otros cuadros clínicos menos comunes son los movimientos involuntarios anormales (corea), la erupción (eritema marginado) y los nódulos subcutáneos.
Los procesos inflamatorios se resuelven lentamente en el transcurso de semanas a meses pero cerca de la mitad de los individuos queda con una cardiopatía reumática crónica. Aunque la muerte por carditis reumática aguda no es común, la cardiopatía reumática crónica causa una morbilidad considerable incluyendo el accidente cerebrovascular, la endocarditis infecciosa, complicaciones del embarazo y muerte prematura.
¿Qué causa la fiebre reumática aguda?
La faringitis estreptocócica es una infección común en la infancia. La faringitis causada por cepas reumatogénicas del estreptococo grupo A en un huésped susceptible desencadena una respuesta inflamatoria inmune anormal. La naturaleza exacta de esta respuesta no se conoce por completo. Se cree que interviene la reactividad cruzada de los anticuerpos anti estreptococo del miocardio, el tejido sinovial y, en la corea, los ganglios basales. El mimetismo molecular dirige la respuesta inmune y la reacción cruzada de los anticuerpos activa el proceso inflamatorio en los tejidos corporales. En la carditis, los autoanticuerpos monoclonales activados producen infiltración de las células T en el endotelio valvular.
¿Quién contrae la enfermedad?
La mayoría de los casos de FRA se produce en niños de 5 a 15 años, pero de vez en cuando puede ocurrir en adultos jóvenes. La mayor incidencia reportada a nivel mundial se encuentra en personas del Pacífico, Nueva Zelanda Maorí e indígenas australianos. En los últimos años, la incidencia ha aumentado en estos grupos de población. En la década de 1980 hubo un resurgimiento de la FRA en las áreas intermontañosas de los Estados Unidos.
Hay pocos datos en sobre la carga de la enfermedad en los países de bajos ingresos más afectados por la enfermedad. Sin embargo, en los últimos años, los estudios epidemiológicos, incluyendo las encuestas que utilizan un registro ecocaardiográfico portátil, han descrito la carga de la cardiopatía reumática en África, Asia y Oceanía, con una prevalencia que oscila entre el 2% y el 6%, mientras que el 90% de los casos detectados mediante ecocardiografía son asintomáticos y subclínicos.
La faringitis estreptocócica es una infección común en la infancia. La faringitis causada por cepas reumatogénicas del estreptococo grupo A en un huésped susceptible desencadena una respuesta inflamatoria inmune anormal. La naturaleza exacta de esta respuesta no se conoce por completo. Se cree que interviene la reactividad cruzada de los anticuerpos anti estreptococo del miocardio, el tejido sinovial y, en la corea, los ganglios basales. El mimetismo molecular dirige la respuesta inmune y la reacción cruzada de los anticuerpos activa el proceso inflamatorio en los tejidos corporales. En la carditis, los autoanticuerpos monoclonales activados producen infiltración de las células T en el endotelio valvular.
¿Quién contrae la enfermedad?
La mayoría de los casos de FRA se produce en niños de 5 a 15 años, pero de vez en cuando puede ocurrir en adultos jóvenes. La mayor incidencia reportada a nivel mundial se encuentra en personas del Pacífico, Nueva Zelanda Maorí e indígenas australianos. En los últimos años, la incidencia ha aumentado en estos grupos de población. En la década de 1980 hubo un resurgimiento de la FRA en las áreas intermontañosas de los Estados Unidos.
Hay pocos datos en sobre la carga de la enfermedad en los países de bajos ingresos más afectados por la enfermedad. Sin embargo, en los últimos años, los estudios epidemiológicos, incluyendo las encuestas que utilizan un registro ecocaardiográfico portátil, han descrito la carga de la cardiopatía reumática en África, Asia y Oceanía, con una prevalencia que oscila entre el 2% y el 6%, mientras que el 90% de los casos detectados mediante ecocardiografía son asintomáticos y subclínicos.
Aunque en familias y grupos étnicos particulares se han observado tasas elevadas de FRA y cardiopatía reumática, la susceptibilidad no es del todo conocida. Incluso en las poblaciones donde hay una exposición permanente al estreptococo del grupo A, solo una pequeña proporción (6%) desarrollará FRA o cardiopatía reumática. El riesgo está fuertemente asociado con el hacinamiento y las carencias socioeconómicas. Un gran estudio africano reciente de las asociaciones del genoma tuvo como objetivo determinar si existe una susceptibilidad genética a la cardiopatía reumática.
| Conceptos actuales • La FRA y su secuela, la cardiopatía reumática crónica, son problemas de salud mundial importantes: Ocurren unos 500.000 casos nuevos por año y 34 millones de personas tiene cardiopatía reumática en todo el mundo. • No existe una prueba de laboratorio para el diagnóstico de FR. • El diagnóstico requiere la presencia de criterios mayores y menores y pruebas de laboratorio de una reciente infección estreptocócica de fauces. Los criterios diagnósticos de Australia y Nueva Zelanda amplían los criterios de Jones de 1992 para la FRA incluyendo la evidencia ecocardiográfica de carditis y un espectro más amplio de manifestaciones articulares como principales criterios. • La penicilina benzatínica intramuscular (bencilpenicilina benzatina) cada 3-4 semanas, durante 10 años después del episodio más reciente de FR, sigue siendo el método más eficaz para prevenir las recurrencias de la FR y la cardiopatía reumática progresiva. |
¿Cómo se diagnostica?
No hay ningún análisis de laboratorio clínico que confirme por sí solo la enfermedad. El diagnóstico se basa en los criterios de Jones, que han sido actualizados recientemente y por primera vez desde 1992. Para confirmar el diagnóstico de un primer episodio de FR se requieren 2 criterios mayores o 1 mayor y 2 menores, además de las pruebas de laboratorio que demuestran la infección de fauces por el estreptococo del grupo A.
No hay ningún análisis de laboratorio clínico que confirme por sí solo la enfermedad. El diagnóstico se basa en los criterios de Jones, que han sido actualizados recientemente y por primera vez desde 1992. Para confirmar el diagnóstico de un primer episodio de FR se requieren 2 criterios mayores o 1 mayor y 2 menores, además de las pruebas de laboratorio que demuestran la infección de fauces por el estreptococo del grupo A.
Los criterios de Jones de la American Heart Association, actualizados junto con los criterios de diagnóstico desarrollados en Nueva Zelanda y Australia (dos países de alta incidencia) reconocen el papel de la ecocardiografía en el diagnóstico de la carditis, junto con las consideraciones epidemiológicas. Los grupos de criterios diagnósticos son el riesgo estratificado y el mejoramiento de la sensibilidad diagnóstica y evitar el subdiagnóstico en las poblaciones de alta incidencia.
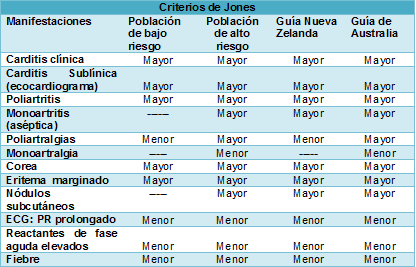
| Criterios mayores |
Carditis (valvulitis)
A nivel mundial, alrededor del 50-65% de las personas con FR tienen carditis clínicamente detectable (inflamación de las valvas cardíacas que conducen a insuficiencia valvular). La válvula mitral es la que más a menudo es afectada, seguida por la válvula aórtica. También se producen pericarditis y miocarditis. La carditis grave ocurre en aproximadamente el 20% y puede conducir a insuficiencia cardiaca congestiva. En casi el 30% de los casos, la carditis reumática puede ser subclínica, es decir, solo detectada por la ecocardiografía y no por la auscultación de soplos.
La carditis reumática puede evolucionar a lo largo de semanas o meses, lo que destaca la importancia de la ecocardiografía repetida a las 2-4 semanas si el primer ecocardiograma es normal.
Artritis
Clásicamente se produce una poliartritis asimétrica migratoria que afecta las grandes articulaciones. Esto causa dolor, tumefacción, limitación del movimiento y calor local. En la práctica, las manifestaciones articulares pueden ser difíciles de evaluar debido a la buena respuesta a los antiinflamatorios no esteroides (AINE), lo que puede enmascarar los síntomas. La monoartritis, especialmente la de la cadera, también ha sido descrita como una característica de presentación en poblaciones con una elevada incidencia de la enfermedad. Actualmente, las 3 guías diagnósticas aceptan a la monoartritis como una manifestación mayor.
Corea
La corea afecta hasta el 15% de las personas con FR y es más común en las mujeres y los adolescentes. Normalmente, la corea aparece después de un período latente más largo (hasta 6 meses), después de una infección estreptocócica, momento en el cual los otros signos inflamatorios de la FR ya han desaparecido. Antes de resolverse, puede seguir un curso fluctuante durante muchos meses, y en ocasiones, durante años. La corea consiste en movimientos espasmódicos involuntarios que pueden ser asimétricos (hemicorea), muecas facial, inquietud, torpeza, y labilidad emocional. Los pacientes pueden experimentar un deterioro de la escritura, la incapacidad para alimentarse ellos mismos y presentar una marcha inestable causante de caídas. Los movimientos coreiformes mejoran durante el sueño. Con el tiempo, hasta el 60% de los pacientes con corea tendrá enfermedad reumática residual, como así problemas neuropsiquiátricos (20% de los casos).
Nódulos subcutáneos
Los nódulos subcutáneos son raros y se describen en <5% de los casos. Son pequeños (<2 cm de diámetro), firmes, indoloros, móviles, y se localizan principalmente en las superficies de extensión de los codos, las muñecas, las rodillas, los tobillos y, de vez en cuando, el tendón de Aquiles y la columna vertebral. Tienen una duración de hasta 2 semanas y suelen aparecer durante las primeras semanas de la fase inflamatoria. Los nódulos se encuentran a menudo asociados a la carditis.
Eritema marginado
El eritema marginado también es un hallazgo poco frecuente (<5% de casos). Puede aparecer un eritema anular en el torso, los brazos y las piernas. Las máculas y pápulas se extienden hacia afuera, con los bordes levantados. El eritema marginado puede fluctuar durante muchas semanas. No pica ni es doloroso. Puede ser difícil de identificar en las personas con la piel más oscura.
A nivel mundial, alrededor del 50-65% de las personas con FR tienen carditis clínicamente detectable (inflamación de las valvas cardíacas que conducen a insuficiencia valvular). La válvula mitral es la que más a menudo es afectada, seguida por la válvula aórtica. También se producen pericarditis y miocarditis. La carditis grave ocurre en aproximadamente el 20% y puede conducir a insuficiencia cardiaca congestiva. En casi el 30% de los casos, la carditis reumática puede ser subclínica, es decir, solo detectada por la ecocardiografía y no por la auscultación de soplos.
La carditis reumática puede evolucionar a lo largo de semanas o meses, lo que destaca la importancia de la ecocardiografía repetida a las 2-4 semanas si el primer ecocardiograma es normal.
Artritis
Clásicamente se produce una poliartritis asimétrica migratoria que afecta las grandes articulaciones. Esto causa dolor, tumefacción, limitación del movimiento y calor local. En la práctica, las manifestaciones articulares pueden ser difíciles de evaluar debido a la buena respuesta a los antiinflamatorios no esteroides (AINE), lo que puede enmascarar los síntomas. La monoartritis, especialmente la de la cadera, también ha sido descrita como una característica de presentación en poblaciones con una elevada incidencia de la enfermedad. Actualmente, las 3 guías diagnósticas aceptan a la monoartritis como una manifestación mayor.
Corea
La corea afecta hasta el 15% de las personas con FR y es más común en las mujeres y los adolescentes. Normalmente, la corea aparece después de un período latente más largo (hasta 6 meses), después de una infección estreptocócica, momento en el cual los otros signos inflamatorios de la FR ya han desaparecido. Antes de resolverse, puede seguir un curso fluctuante durante muchos meses, y en ocasiones, durante años. La corea consiste en movimientos espasmódicos involuntarios que pueden ser asimétricos (hemicorea), muecas facial, inquietud, torpeza, y labilidad emocional. Los pacientes pueden experimentar un deterioro de la escritura, la incapacidad para alimentarse ellos mismos y presentar una marcha inestable causante de caídas. Los movimientos coreiformes mejoran durante el sueño. Con el tiempo, hasta el 60% de los pacientes con corea tendrá enfermedad reumática residual, como así problemas neuropsiquiátricos (20% de los casos).
Nódulos subcutáneos
Los nódulos subcutáneos son raros y se describen en <5% de los casos. Son pequeños (<2 cm de diámetro), firmes, indoloros, móviles, y se localizan principalmente en las superficies de extensión de los codos, las muñecas, las rodillas, los tobillos y, de vez en cuando, el tendón de Aquiles y la columna vertebral. Tienen una duración de hasta 2 semanas y suelen aparecer durante las primeras semanas de la fase inflamatoria. Los nódulos se encuentran a menudo asociados a la carditis.
Eritema marginado
El eritema marginado también es un hallazgo poco frecuente (<5% de casos). Puede aparecer un eritema anular en el torso, los brazos y las piernas. Las máculas y pápulas se extienden hacia afuera, con los bordes levantados. El eritema marginado puede fluctuar durante muchas semanas. No pica ni es doloroso. Puede ser difícil de identificar en las personas con la piel más oscura.
| Criterios menores |
Artralgia
Si hay poliartritis, entonces la artralgia no puede ser utilizada como una característica secundaria de la FRA. Puede que no haya signos de artritis manifiesta, sobre todo cuando se han utilizado AINE. Las manifestaciones articulares pueden tener un curso fluctuante de días a varias semanas y puede ser difícil diferenciar la artritis de la artralgia, solo basados en la historia.
Bloqueo cardíaco de primer grado
En ausencia de carditis, el bloqueo cardíaco de primer grado puede ser incluido como uno de los criterios menores para apoyar el diagnóstico de FR. El intervalo PR del electrocardiograma debe interpretarse de acuerdo a la edad y la frecuencia cardíaca. En los niños <12 años, el límite superior del intervalo PR normal es 0,16 segundos y de 0,18 segundos para los ≥12 años.
Fiebre
Pueden producirse diversos patrones febriles. La respuesta a la fiebre es muy sensible a los medicamentos antiinflamatorios, y el uso generalizado de paracetamol y AINE puede hacer que el período febril sea corto.
Por el contrario, cuando los pacientes con FR tienen una marcada respuesta inflamatoria y evolucionan con artritis y carditis, entonces se puede observar la persistencia de la fiebre. Actualmente, una sola medición ≥38°C en las poblaciones de alto riesgo es aceptada como prueba suficiente de fiebre y un criterio menor para la FR.
Reactantes de fase aguda elevados
La velocidad de eritrosedimentación (VES) es elevada, por lo general es >50 mm en la primera hora; las guías diagnósticas usan variados umbrales ≥30 mm. La VES permanece elevada durante varias semanas, a menudo hasta después de la desaparición de los síntomas, y tarda varios meses en normalizarse. Las concentraciones de la proteína C reactiva también están elevadas, pero por lo general suben y bajan más rápidamente que la VES. Los marcadores inflamatorios elevados son inespecíficos y pueden ocurrir con la infección y otras condiciones inflamatorias.
Evidencia de infección previa con el estreptococo del grupo A
Según los criterios de Jones, la confirmación de la respuesta inmune a la faringitis estreptocócica grupo A requiere un cultivo faríngeo positivo o un título de anticuerpos anti estreptococos elevado, pero estas investigaciones de laboratorio pueden no estar disponibles en muchos de los países de recursos limitados donde la FR es común. Los anticuerpos anti estreptocócicos incluyen los anticuerpos anti desoxirribonucleico (Anti-ADNasa B) y anti estreptolisina (ASOT). Los títulos de anticuerpos pueden aumentar durante varias semanas e ir disminuyendo durante varios meses. Un aumento de 4 veces o la caída de los títulos es diagnóstico de una infección estreptocócica reciente. Se han desarrollado rangos de referencia para ayudar a interpretar los títulos de anticuerpos contra los estreptococos en las poblaciones de alto riesgo.
Otras características clínicas
En la FR se ha descrito dolor abdominal, nefritis, anemia, neumonía y epistaxis (particularmente asociados a la insuficiencia aórtica significativa); estas características fueron reconocidas en los criterios de Duckett Jones originales de 1992.
¿Qué diagnósticos alternativos deben considerarse?
La FR sigue siendo un diagnóstico clínico. Cuando una persona tiene manifestaciones que no cumplen todos los criterios diagnósticos se deben considerar diversas alternativas.
Si hay poliartritis, entonces la artralgia no puede ser utilizada como una característica secundaria de la FRA. Puede que no haya signos de artritis manifiesta, sobre todo cuando se han utilizado AINE. Las manifestaciones articulares pueden tener un curso fluctuante de días a varias semanas y puede ser difícil diferenciar la artritis de la artralgia, solo basados en la historia.
Bloqueo cardíaco de primer grado
En ausencia de carditis, el bloqueo cardíaco de primer grado puede ser incluido como uno de los criterios menores para apoyar el diagnóstico de FR. El intervalo PR del electrocardiograma debe interpretarse de acuerdo a la edad y la frecuencia cardíaca. En los niños <12 años, el límite superior del intervalo PR normal es 0,16 segundos y de 0,18 segundos para los ≥12 años.
Fiebre
Pueden producirse diversos patrones febriles. La respuesta a la fiebre es muy sensible a los medicamentos antiinflamatorios, y el uso generalizado de paracetamol y AINE puede hacer que el período febril sea corto.
Por el contrario, cuando los pacientes con FR tienen una marcada respuesta inflamatoria y evolucionan con artritis y carditis, entonces se puede observar la persistencia de la fiebre. Actualmente, una sola medición ≥38°C en las poblaciones de alto riesgo es aceptada como prueba suficiente de fiebre y un criterio menor para la FR.
Reactantes de fase aguda elevados
La velocidad de eritrosedimentación (VES) es elevada, por lo general es >50 mm en la primera hora; las guías diagnósticas usan variados umbrales ≥30 mm. La VES permanece elevada durante varias semanas, a menudo hasta después de la desaparición de los síntomas, y tarda varios meses en normalizarse. Las concentraciones de la proteína C reactiva también están elevadas, pero por lo general suben y bajan más rápidamente que la VES. Los marcadores inflamatorios elevados son inespecíficos y pueden ocurrir con la infección y otras condiciones inflamatorias.
Evidencia de infección previa con el estreptococo del grupo A
Según los criterios de Jones, la confirmación de la respuesta inmune a la faringitis estreptocócica grupo A requiere un cultivo faríngeo positivo o un título de anticuerpos anti estreptococos elevado, pero estas investigaciones de laboratorio pueden no estar disponibles en muchos de los países de recursos limitados donde la FR es común. Los anticuerpos anti estreptocócicos incluyen los anticuerpos anti desoxirribonucleico (Anti-ADNasa B) y anti estreptolisina (ASOT). Los títulos de anticuerpos pueden aumentar durante varias semanas e ir disminuyendo durante varios meses. Un aumento de 4 veces o la caída de los títulos es diagnóstico de una infección estreptocócica reciente. Se han desarrollado rangos de referencia para ayudar a interpretar los títulos de anticuerpos contra los estreptococos en las poblaciones de alto riesgo.
Otras características clínicas
En la FR se ha descrito dolor abdominal, nefritis, anemia, neumonía y epistaxis (particularmente asociados a la insuficiencia aórtica significativa); estas características fueron reconocidas en los criterios de Duckett Jones originales de 1992.
¿Qué diagnósticos alternativos deben considerarse?
La FR sigue siendo un diagnóstico clínico. Cuando una persona tiene manifestaciones que no cumplen todos los criterios diagnósticos se deben considerar diversas alternativas.

¿Cómo se trata la fiebre reumática aguda?
Manejo inicial ante la sospecha diagnóstica
La mayoría de las personas con diagnóstico presuntivo de FR está hospitalizada para hacer los estudios confirmatorios e iniciar el tratamiento. El tratamiento de la fase inflamatoria aguda es de apoyo y tienen como objetivo proporcionar el alivio sintomático de la artritis, la atención de apoyo para la carditis y la educación del paciente y la familia. Después de obtener un hisopado de fauces, se inicia el tratamiento con penicilina para erradicar el Streptococcus grupo A de la faringe. Ya sea la fenoximetilpenicilina (penicilina VK) por vía oral, 250 mg 2 veces/día en los niños, o 500 mg 2 veces/día en los adolescentes, durante 10 días; también puede administrarse una sola dosis de penicilina benzatínica intramuscular (bencilpenicilina benzatína) hasta que se establezca la profilaxis antibiótica secundaria a largo plazo. Para los pacientes con alergia a la penicilina, una alternativa es la eritromicina.
Profilaxis antibiótica
Después de un episodio de FRA se recomienda la profilaxis antibiótica secundaria para prevenir la infección estreptocócica grupo A y la FR recurrente. En 2006, una revisión sistemática de Cochrane, basada en datos de cohorte mostró que para la profilaxis de la FR recurrente, la profilaxis con penicilina benzatínica intramuscular es superior a la falta de profilaxis o la penicilina oral. La penicilina benzatínica también mejora los resultados cardíacos a largo plazo en pacientes con carditis reumática. La penicilina benzatínica intramuscular es el método de profilaxis recomendado por la OMS, y se administra cada 3-4 semanas. También hay menor recurrencia aplicando 3 dosis semanales, pero con un régimen de 4 dosis semanales la tasa de recurrencia es baja, con una buena adherencia al tratamiento. Para los pacientes con alergia a la penicilina, el antibiótico alternativo recomendado es la eritromicina.
Las recomendaciones sobre la duración de la profilaxis secundaria están basadas en la opinión de especialistas, y en haberse observado que las recurrencias son extremadamente infrecuentes después de los 21 años o más allá de los 10 años del primer episodio. La práctica varía, pero en la mayoría de las regiones se utiliza la profilaxis con. Para los pacientes con carditis, la penicilina benzatínica se continúa por lo menos durante 10 años después del diagnóstico (también recomendado por la OMS).
En los individuos con cardiopatía reumática grave, la profilaxis se debe continuar por más tiempo, sobre todo en aquellos que han sido operados o han sufrido recurrencias cardíaco. En esta situación, las guías de Nueva Zelanda y Australia recomiendan la profilaxis hasta los 40 años o más. Un ensayo clínico reciente demostró que el dolor de la inyección puede reducirse mediante el uso de lidocaína como diluyente de la penicilina benzatínica, sin afectar a la concentración del fármaco en los líquidos corporales.
Control de los síntomas específicos de la fiebre reumática
Carditis
En 2006, una revisión sistemática de Cochrane que incluyó ensayos clínicos encontró que ni la aspirina ni los corticoides mejoraron los resultados cardíacos, 1 año después del diagnóstico. Sin embargo, algunos médicos creen que los corticosteroides tienen un papel en la fase inflamatoria aguda de carditis grave, particularmente para los pacientes con derrame pericárdico o pancarditis grave. Para los pacientes con carditis moderada a grave se sigue recomendando el reposo en cama durante varias semanas seguido de una deambulación suave, pero esta práctica no ha sido evaluada científicamente en los últimos años.
La mayoría de las personas con diagnóstico presuntivo de FR está hospitalizada para hacer los estudios confirmatorios e iniciar el tratamiento. El tratamiento de la fase inflamatoria aguda es de apoyo y tienen como objetivo proporcionar el alivio sintomático de la artritis, la atención de apoyo para la carditis y la educación del paciente y la familia. Después de obtener un hisopado de fauces, se inicia el tratamiento con penicilina para erradicar el Streptococcus grupo A de la faringe. Ya sea la fenoximetilpenicilina (penicilina VK) por vía oral, 250 mg 2 veces/día en los niños, o 500 mg 2 veces/día en los adolescentes, durante 10 días; también puede administrarse una sola dosis de penicilina benzatínica intramuscular (bencilpenicilina benzatína) hasta que se establezca la profilaxis antibiótica secundaria a largo plazo. Para los pacientes con alergia a la penicilina, una alternativa es la eritromicina.
Profilaxis antibiótica
Después de un episodio de FRA se recomienda la profilaxis antibiótica secundaria para prevenir la infección estreptocócica grupo A y la FR recurrente. En 2006, una revisión sistemática de Cochrane, basada en datos de cohorte mostró que para la profilaxis de la FR recurrente, la profilaxis con penicilina benzatínica intramuscular es superior a la falta de profilaxis o la penicilina oral. La penicilina benzatínica también mejora los resultados cardíacos a largo plazo en pacientes con carditis reumática. La penicilina benzatínica intramuscular es el método de profilaxis recomendado por la OMS, y se administra cada 3-4 semanas. También hay menor recurrencia aplicando 3 dosis semanales, pero con un régimen de 4 dosis semanales la tasa de recurrencia es baja, con una buena adherencia al tratamiento. Para los pacientes con alergia a la penicilina, el antibiótico alternativo recomendado es la eritromicina.
Las recomendaciones sobre la duración de la profilaxis secundaria están basadas en la opinión de especialistas, y en haberse observado que las recurrencias son extremadamente infrecuentes después de los 21 años o más allá de los 10 años del primer episodio. La práctica varía, pero en la mayoría de las regiones se utiliza la profilaxis con. Para los pacientes con carditis, la penicilina benzatínica se continúa por lo menos durante 10 años después del diagnóstico (también recomendado por la OMS).
En los individuos con cardiopatía reumática grave, la profilaxis se debe continuar por más tiempo, sobre todo en aquellos que han sido operados o han sufrido recurrencias cardíaco. En esta situación, las guías de Nueva Zelanda y Australia recomiendan la profilaxis hasta los 40 años o más. Un ensayo clínico reciente demostró que el dolor de la inyección puede reducirse mediante el uso de lidocaína como diluyente de la penicilina benzatínica, sin afectar a la concentración del fármaco en los líquidos corporales.
Control de los síntomas específicos de la fiebre reumática
Carditis
En 2006, una revisión sistemática de Cochrane que incluyó ensayos clínicos encontró que ni la aspirina ni los corticoides mejoraron los resultados cardíacos, 1 año después del diagnóstico. Sin embargo, algunos médicos creen que los corticosteroides tienen un papel en la fase inflamatoria aguda de carditis grave, particularmente para los pacientes con derrame pericárdico o pancarditis grave. Para los pacientes con carditis moderada a grave se sigue recomendando el reposo en cama durante varias semanas seguido de una deambulación suave, pero esta práctica no ha sido evaluada científicamente en los últimos años.
Los diuréticos y los vasodilatadores se utilizan en la carditis grave. Normalmente, en la insuficiencia cardíaca congestiva leve a moderada se indica furosemida. Los inhibidores de la enzima convertidora de angiotensina tienen un papel particular en la regurgitación aórtica grave, ya que reducen la poscarga cardíaca. La ecocardiografía seriada para medir las dimensiones y la función cardíaca puede ayudar a los cardiólogos a determinar si es necesaria la cirugía valvular. En muchos pacientes, la gravedad de la carditis se estabiliza o mejora en semanas a meses, ya que la fase inflamatoria se resuelve en ese lapso. Siempre que sea posible, la cirugía se retrasa hasta que la inflamación activa se ha estabilizado, ya que la cirugía durante la fase inflamatoria aguda se asocia con mayores tasas de fracaso.
Siempre que sea posible, la reparación de la válvula mitral es mejor con la sustitución mecánica. La cirugía de reparación ha arrojado excelentes resultados (supervivencia 90% y falta de necesidad de una reoperación en el 75% de los casos, a los 10 años), lo que evita la necesidad de hacer un tratamiento anticoagulante a largo plazo.
Corea
La corea es un diagnóstico clínico que se realiza después de una cuidadosa evaluación para excluir otras causas. Es importante tener en cuenta si los niños que presentan corea podrían tener la enfermedad de Wilson, un trastorno autoinmune, u otra enfermedad neurometabólica. Pueden estar indicadas investigaciones de laboratorio y por neuroimágenes, sobre todo si no hay otras características que apoyen el diagnóstico de FR y si el niño pertenece a una población en la que la FR es poco común, o hay características atípicas.
El tratamiento de la corea es de apoyo. Los pacientes y cuidadores deben estar informados acerca de la posibilidad de que la corea continúe durante varios meses y fluctúe durante las épocas de enfermedades intercurrentes y estrés. Se necesita un enfoque multidisciplinario que incluya el apoyo psicosocial y el apoyo para asegurar que el niño está a salvo de las caídas.
Hay pocos datos para orientar el tratamiento de la corea. Algunas series de casos pequeñas han demostrado que el valproato de sodio y la carbamacepina son igualmente eficaces y bien tolerados para reducir los movimientos involuntarios. Se debe evitar el haloperidol y otros neurolépticos debido a la posibilidad de efectos secundarios extrapiramidales. Un pequeño estudio aleatorizado comparó la inmunoglobulina intravenosa, el intercambio plasmático con un curso corto de corticosteroides y halló que los 3 agentes lograron la mejoría, 1 mes después del tratamiento. Más mejoría se observó con la inmunoglobulina intravenosa y el intercambio de plasma en comparación con los esteroides orales. Para todos los casos de corea se recomienda la penicilina benzatínica debido a la fuerte asociación con la carditis y eventualmente, la cardiopatía reumática.
Artritis y artralgias
Las manifestaciones articulares de la FRA pueden ser extremadamente dolorosas. Los AINE pueden enmascarar los signos de la FRA siendo el paracetamol el tratamiento sintomático de preferencia hasta que se establezca el diagnóstico (basado en el criterio clínico).
Una vez que el diagnóstico es seguro, el0 tratamiento de elección es 10-20 mg/kg/día de naproxeno, 2 veces/día. Un pequeño estudio aleatorizado y controlado mostró que el naproxeno es equivalente a la aspirina para el tratamiento de la artritis, y es menos probable que cause alteraciones de las enzimas hepáticas. El ibuprofeno se puede utilizar, pero su seguridad y eficacia no han sido comparadas con las del naproxeno. Los autores afirman que generalmente la respuesta a los AINE se produce varios días después de iniciado ese tratamiento. La mayoría de los casos requiere 1 o 2 semanas de tratamiento ordinario con AINE, y es poco común que se necesiten más de varias semanas.
¿Cuáles son las complicaciones a largo plazo?
Para muchas personas con carditis leve a moderada el grado de regurgitación valvular se estabiliza o mejora dentro de los 12 meses posteriores al diagnóstico. En los individuos que experimentan carditis grave durante el episodio inicial, la recurrencia de la FR tienen el mayor riesgo de enfermedad cardíaca reumática crónica grave, que se asocia con un mayor riesgo de insuficiencia cardíaca, endocarditis infecciosa, complicaciones gestacionales, accidente cerebrovascular, arritmias y muerte prematura. Es necesaria una atención cuidadosa para asegurar una buena adherencia a la profilaxis con penicilina benzatínica.
Siempre que sea posible, la reparación de la válvula mitral es mejor con la sustitución mecánica. La cirugía de reparación ha arrojado excelentes resultados (supervivencia 90% y falta de necesidad de una reoperación en el 75% de los casos, a los 10 años), lo que evita la necesidad de hacer un tratamiento anticoagulante a largo plazo.
Corea
La corea es un diagnóstico clínico que se realiza después de una cuidadosa evaluación para excluir otras causas. Es importante tener en cuenta si los niños que presentan corea podrían tener la enfermedad de Wilson, un trastorno autoinmune, u otra enfermedad neurometabólica. Pueden estar indicadas investigaciones de laboratorio y por neuroimágenes, sobre todo si no hay otras características que apoyen el diagnóstico de FR y si el niño pertenece a una población en la que la FR es poco común, o hay características atípicas.
El tratamiento de la corea es de apoyo. Los pacientes y cuidadores deben estar informados acerca de la posibilidad de que la corea continúe durante varios meses y fluctúe durante las épocas de enfermedades intercurrentes y estrés. Se necesita un enfoque multidisciplinario que incluya el apoyo psicosocial y el apoyo para asegurar que el niño está a salvo de las caídas.
Hay pocos datos para orientar el tratamiento de la corea. Algunas series de casos pequeñas han demostrado que el valproato de sodio y la carbamacepina son igualmente eficaces y bien tolerados para reducir los movimientos involuntarios. Se debe evitar el haloperidol y otros neurolépticos debido a la posibilidad de efectos secundarios extrapiramidales. Un pequeño estudio aleatorizado comparó la inmunoglobulina intravenosa, el intercambio plasmático con un curso corto de corticosteroides y halló que los 3 agentes lograron la mejoría, 1 mes después del tratamiento. Más mejoría se observó con la inmunoglobulina intravenosa y el intercambio de plasma en comparación con los esteroides orales. Para todos los casos de corea se recomienda la penicilina benzatínica debido a la fuerte asociación con la carditis y eventualmente, la cardiopatía reumática.
Artritis y artralgias
Las manifestaciones articulares de la FRA pueden ser extremadamente dolorosas. Los AINE pueden enmascarar los signos de la FRA siendo el paracetamol el tratamiento sintomático de preferencia hasta que se establezca el diagnóstico (basado en el criterio clínico).
Una vez que el diagnóstico es seguro, el0 tratamiento de elección es 10-20 mg/kg/día de naproxeno, 2 veces/día. Un pequeño estudio aleatorizado y controlado mostró que el naproxeno es equivalente a la aspirina para el tratamiento de la artritis, y es menos probable que cause alteraciones de las enzimas hepáticas. El ibuprofeno se puede utilizar, pero su seguridad y eficacia no han sido comparadas con las del naproxeno. Los autores afirman que generalmente la respuesta a los AINE se produce varios días después de iniciado ese tratamiento. La mayoría de los casos requiere 1 o 2 semanas de tratamiento ordinario con AINE, y es poco común que se necesiten más de varias semanas.
¿Cuáles son las complicaciones a largo plazo?
Para muchas personas con carditis leve a moderada el grado de regurgitación valvular se estabiliza o mejora dentro de los 12 meses posteriores al diagnóstico. En los individuos que experimentan carditis grave durante el episodio inicial, la recurrencia de la FR tienen el mayor riesgo de enfermedad cardíaca reumática crónica grave, que se asocia con un mayor riesgo de insuficiencia cardíaca, endocarditis infecciosa, complicaciones gestacionales, accidente cerebrovascular, arritmias y muerte prematura. Es necesaria una atención cuidadosa para asegurar una buena adherencia a la profilaxis con penicilina benzatínica.
En Australasia se recomienda la profilaxis antibiótica de la endocarditis antes de los procedimientos dentales para todas las personas con enfermedad cardíaca reumática, a diferencia de la guía de la American Heart Association, que restringe los antibióticos a un pequeño grupo con mayor riesgo de experimentar resultados adversos de la endocarditis. En el Reino Unido, el National Institute of Health and Care Excellence (NICE) aboga por la no administración de antibióticos profilácticos bajo ninguna circunstancia.
¿Cuáles son las consecuencias para la salud de la población?
A nivel mundial, hasta el 40% de los niños y adultos con cardiopatía reumática no tiene antecedentes de un episodio reconocido de FR. La OMS recomienda la búsqueda activa de casos, y cuando se comprueba que los niños o los adultos de las poblaciones de alta incidencia o, con antecedentes demográficos, tienen soplos cardíacos o complicaciones, se debe hacer una ecocardiografía siempre que sea posible para buscar la enfermedad cardíaca reumática. Los World Heart Federation Consensus Diagnostic Criteria permiten ahora un enfoque global coherente para el diagnóstico ecocardiográfico.
¿Cuáles son las consecuencias para la salud de la población?
A nivel mundial, hasta el 40% de los niños y adultos con cardiopatía reumática no tiene antecedentes de un episodio reconocido de FR. La OMS recomienda la búsqueda activa de casos, y cuando se comprueba que los niños o los adultos de las poblaciones de alta incidencia o, con antecedentes demográficos, tienen soplos cardíacos o complicaciones, se debe hacer una ecocardiografía siempre que sea posible para buscar la enfermedad cardíaca reumática. Los World Heart Federation Consensus Diagnostic Criteria permiten ahora un enfoque global coherente para el diagnóstico ecocardiográfico.
En los últimos años se ha realizado el cribado ecocardiográfico en la población para detectar la enfermedad cardiaca reumática, en las regiones con incidencia elevada de FR. Actualmente se está evaluando el potencial de riesgos, beneficios y papel futuro del cribado ecocardiográfico de los programas de control de la cardiopatía reumática. La última década ha sido testigo de la creciente conciencia de la necesidad de hacer esfuerzos mundiales integrales y coordinados para el controlar de la FR y la cardiopatía reumática.
Se están considerando varias estrategias de prevención primaria, incluyendo el desarrollo de una vacuna eficaz para el estreptococo del grupo A y mejorar la concientización de la población y el tratamiento de la faringitis por estreptococo del grupo A. En Nueva Zelanda se está desarrollando un programa para el dolor de garganta en escolares. La World Heart Federation ha hecho grandes esfuerzos para fortalecer los registros basados en los sistemas para la realización de la profilaxis con penicilina benzatínica y el seguimiento clínico de las personas físicas con cardiopatía reumática. Existen registros globales que están recopilando los datos de morbilidad y mortalidad en regiones como África donde los datos epidemiológicos previos son limitados.
Hay una asociación reconocida entre el hacinamiento de los hogares y la FR. Para establecer las estrategias futuras de prevención primaria se necesitan con urgencia estudios diseñados para evaluar el papel de los factores de riesgo ambientales específicos y la eficacia de las intervenciones específicas.
Preguntas para investigaciones futuras
• ¿Cómo mejorar el conocimiento de la patogénesis de la FRA?
• ¿Cómo mejorar la vigilancia a fin de que la carga mundial verdadera pueda ser estimada con más precisión?
• ¿Cuál es el papel de la detección ecocardiografía portátil en los programas de control de la enfermedad cardíaca reumática en poblaciones de alto riesgo?
• ¿Pueden los nuevos tratamientos inmunomoduladores mejorar los resultados cardiacos y evitar la cirugía?
• ¿Son rentables los programas de prevención primaria (hisopado faríngeo) en las poblaciones de alta incidencia para reducir la carga de la cardiopatía reumática?
• ¿Puede una vacuna contra el estreptococo del grupo A prevenir la FRA y la cardiopatía reumática?
Hay una asociación reconocida entre el hacinamiento de los hogares y la FR. Para establecer las estrategias futuras de prevención primaria se necesitan con urgencia estudios diseñados para evaluar el papel de los factores de riesgo ambientales específicos y la eficacia de las intervenciones específicas.
Preguntas para investigaciones futuras
• ¿Cómo mejorar el conocimiento de la patogénesis de la FRA?
• ¿Cómo mejorar la vigilancia a fin de que la carga mundial verdadera pueda ser estimada con más precisión?
• ¿Cuál es el papel de la detección ecocardiografía portátil en los programas de control de la enfermedad cardíaca reumática en poblaciones de alto riesgo?
• ¿Pueden los nuevos tratamientos inmunomoduladores mejorar los resultados cardiacos y evitar la cirugía?
• ¿Son rentables los programas de prevención primaria (hisopado faríngeo) en las poblaciones de alta incidencia para reducir la carga de la cardiopatía reumática?
• ¿Puede una vacuna contra el estreptococo del grupo A prevenir la FRA y la cardiopatía reumática?
Fuente: Department of Paediatric Infectious Diseases, Starship Children’s Hospital, Auckland 1023, New Zealand; Department of Paediatrics: Child and Youth Health, University of Auckland, Auckland, New Zealand; Department of General Paediatrics, Starship Children’s Hospital, Auckland 1023, New Zealand; Department of Primary Health Care Sciences, Oxford University, Oxford OX3 7LF, UK
Traducción y resumen objetivo: Dra. Marta Papponetti
