Resumen
Los análisis clínicos son útiles para el diagnóstico de las enfermedades reumáticas, pero los médicos deben conocer las limitaciones de estos análisis.
Este artículo presenta casos clínicos a fin de proporcionar orientación práctica basada en la evidencia para indicar e interpretar determinados análisis, entre ellos el factor reumatoide, anticuerpo antipéptido citrulinado, los anticuerpos antinucleares, los anticuerpos antifosfolípidos, anticuerpos anticitoplasma de neutrófilos y el análisis del antígeno leucocitario humano B27. |
La indicación de los análisis clínicos con frecuencia es inapropiada para los pacientes en quienes se sospecha una enfermedad reumatológica.
Los resultados
negativos de estos análisis no siempre son tranquilizadores y los resultados falso positivos tienen el riesgo de ansiedad innecesaria en pacientes y médicos, interconsultas inútiles y morbilidad potencial debido a otras pruebas innecesarias y exposición a tratamientos equivocados. Los médicos deben conocer los inconvenientes de estos análisis a fin de elegirlos bien e interpretar correctamente los resultados.
Este artículo proporciona orientación práctica para indicar e interpretar algunos análisis comunes en reumatología, con la ayuda de algunos casos clínicos.
| Factor reumatoide y anticuerpos antipéptidos citrulinados |
Viñeta clínica
Una mujer de 41 años, con buena salud previa, consulta a su médico de atención primaria por los siguientes síntomas que comenzaron hace 6 semanas: dolor y tumefacción de las manos y rigidez al despertar, que dura alrededor de 2 horas. No sufre síntomas extraarticulares. El examen físico revela sinovitis en las articulaciones metacarpofalángicas derechas, la articulación interfalángica del dedo mayor izquierdo y la muñeca izquierda. El médico interpreta que sus síntomas se podrían deber a artritis reumatoide.
¿Los análisis para factor reumatoide y anticuerpo antipéptido citrulinado serían útiles para esta paciente?
El factor reumatoide es un anticuerpo (inmunoglobulina M, IgG, o IgA) dirigido contra el fragmento Fc de la IgG. Se llama así porque se detectó originalmente en pacientes con artritis reumatoide, pero no es sensible ni específico para esta enfermedad.
Otras numerosas enfermedades se pueden asociar con una prueba positiva para el factor reumatoide. Por lo tanto, el diagnóstico de artritis reumatoide no se puede confirmar solo con un resultado positivo, ni se puede descartar con un resultado negativo.
En cambio, el anticuerpo antipéptido citrulinado es mucho más específico para la artritis reumatoide (95%), ya que rara vez se lo halla en otras enfermedades, pero su sensibilidad es similar a la del factor reumatoide (68%). El resultado positivo reforzaría el diagnóstico de artritis reumatoide, pero el resultado negativo no lo descartaría.
> Enfoque de la artritis incipiente
Ante un paciente con artritis incipiente, algunas preguntas clave son:
¿Es un problema inflamatorio o mecánico? En la artritis inflamatoria hay tumefacción articular que no se debe a traumatismo o hipertrofia ósea, rigidez al comienzo del día, que no dura más de 30 minutos y aumento de los marcadores inflamatorios (eritrosedimentación o proteína C reactiva). La afectación de las pequeñas articulaciones de manos y pies se puede evidenciar por dolor a la compresión de las articulaciones metacarpofalángicas y metatarsofalángicas, respectivamente.
¿Existe una causa subyacente identificable de la artritis inflamatoria? Las características del desarrollo de los síntomas articulares o la presencia de síntomas extraarticulares puede sugerir un problema de base, como gota, artritis soriásica, lupus eritematoso sistémico o sarcoidosis.
Si la artritis es indiferenciada (es decir, no hay una causa definida identificable), ¿Es probable que remita o persista? Esta quizás sea la pregunta más importante para el pronóstico. Los pacientes con factores de riesgo para enfermedad persistente, es decir para el desarrollo de artritis reumatoide, deben ser derivados a un reumatólogo para el tratamiento a tiempo con fármacos antirreumáticos modificadores de la enfermedad. Numerosos estudios mostraron que cuando este tratamiento se inicia tempranamente los pacientes tienen resultados clínicos, funcionales y radiológicos mucho mejores que aquellos en quienes el tratamiento se demora.
Los criterios modificados del
American College of Rheumatology y la
European League Against Rheumatism incluyen los siguientes factores pronósticos de persistencia:
• Cantidad de articulaciones afectadas (con mayor importancia dada a la afectación de las pequeñas articulaciones)
• Duración de los síntomas 6 semanas o más
• Aumento de la respuesta de fase aguda (eritrosedimentación o proteína C-reactiva)
• Prueba serológica positiva (factor reumatoide o anticuerpo antipéptido citrulinado)
Si ambos son positivos en un paciente con artritis incipiente indiferenciada, el riesgo de progresión a artritis reumatoide es de casi el 100%.
Esto señala la importancia de los análisis para estos anticuerpos. Sin embargo, la derivación al reumatólogo no se debe demorar cuando los análisis son negativos (más de un tercio de los pacientes con artritis reumatoide) y se la debe considerar en aquellos con síntomas articulares inflamatorios que persisten durante más de 6 semanas, especialmente con afectación de las pequeñas articulaciones (salvo las inrterfalángicas distales) y aumento de la respuesta de fase aguda.
> Factor reumatoide en personas sanas asintomáticas
En algunos países, el análisis para el factor reumatoide se ofrece como parte de una batería de pruebas de pesquisa en personas sanas asintomáticas, práctica que debe ser desalentada, ya que no existe ninguna estrategia para prevenir la aparición de artritis reumatoide y el tratamiento modificador de la enfermedad no es útil durante la fase preclínica.
> Volvemos a nuestra paciente
Los análisis de sangre en nuestra paciente revelan que el hemograma completo, las aminotransferasas (transaminasas) y la creatinina son normales, al igual que el examen de orina. La eritrosedimentación es 56 mm/hora (normal 0–15) y la proteína C reactiva es 26 mg/dl (normal < 3).
Los análisis son negativos para el factor reumatoide y el anticuerpo antipéptido citrulinado. A pesar de esto, se la deriva a un reumatólogo debido a que tiene factores pronósticos para enfermedad persistente, como duración de 6 semanas de los síntomas, afectación de las pequeñas articulaciones de las manos y aumento de la eritrosedimentación y de la proteína C reactiva. El reumatólogo indica serología para parvovirus, que es negativa.
Se le administran corticoides de liberación prolongada, a los que responde durante un corto tiempo. Debido a que los síntomas persisten y empeoran, se inicia el tratamiento con metotrexato después de otras 6 semanas.
Una mujer de 37 años consulta a su médico de atención primaria debido a que sufre cansancio. Tiene antecedentes familiares de lupus eritematoso sistémico en su hermana y una tía materna. Está preocupada por el lupus y solicita análisis para descartarlo.
¿Sería razonable indicar análisis para anticuerpo antinuclear?
El anticuerpo antinuclear no es un único anticuerpo, sino una familia de anticuerpos contra constituyentes nucleares como el ácido desoxiribonucleico de cadena simple o doble (dsDNA), histonas, centrómeros, proteínas integradas con el ácido ribonucleico (ARN) y enzimas como la topoisomerasa.
Antígenos proteicos integrados con el con ARN y algunas enzimas del núcleo también se conocen como antígenos nucleares extraíbles (ENAs).
Los análisis del anticuerpo antinuclear se indican para descartar enfermedades del tejido conjuntivo como el
lupus, pero es necesario que el médico recuerde los siguientes puntos:
> El anticuerpo antinuclear se puede hallar en otras enfermedades además del lupus:
• Otras enfermedades autoinmunes como artritis reumatoide, síndrome de Sjögren primario, esclerosis sistémica, tiroiditis auntoinmune y miastenia gravis
• Infección con microorganismos que comparten el epítopo con autoantígenos (mimetismo molecular)
• Tumores malignos
• Fármacos como hidralazina, procainamida y minociclina.
El anticuerpo antinuclear también podría ser producido de vez en cuando por el sistema inmune sano para eliminar los residuos nucleares expulsados de las células que envejecen. |
Un estudio en personas sanas halló que el resultado positivo fue más frecuente entre familiares de pacientes con enfermedades autoinmunes del tejido conjuntivo. Por consiguiente, el resultado positivo del análisis de anticuerpos antinucleares no siempre significa lupus.
> El análisis de anticuerpos antinucleares es muy sensible para el lupus
Su sensibilidad es cercana al 100%. Por lo tanto el resultado negativo prácticamente descarta el lupus.
Hay dos métodos para el análisis de anticuerpos antinucleares: la inmunofluorescencia indirecta y el ensayo por inmunoabsorción ligado a enzimas (ELISA). Aunque el ELISA es más sencillo, la sensibilidad de la inmunofluorescencia es ligeramente mayor y se la continúa considerando el método de referencia.
La mayor sensibilidad es a expensas de menor especificidad (alrededor del 60%), de modo los anticuerpos antinucleares se detectarán también en todas las otras enfermedades mencionadas más arriba. Para mejorar la especificidad de la prueba de anticuerpos antinucleares, los laboratorios informan los títulos (la dilución más alta del suero que da positivo); el punto de corte >1/80 en general se considera significativo.
> No se debe indicar indiscriminadamente el análisis de anticuerpos antinucleares
Si el análisis de anticuerpos antinucleares se solicita indiscriminadamente, el valor pronóstico positivo para el diagnóstico de lupus es de solo el 11%.
Se lo debe indicar solo ante una gran probabilidad de lupus o alguna otra enfermedad del tejido conjuntivo. El valor pronóstico positivo es mucho mayor en pacientes con manifestaciones clínicas o de laboratorio que afectan 2 o más sistemas orgánicos.
La clasificación del antígeno específico sobre el cual actúan los anticuerpos antinucleares mejora la especificidad. El anticuerpo antinuclear en pacientes con lupus puede actuar sobre el ADN de cadena simple o doble, histonas o uno o más de los ENA.
Entre estos, la presencia de anti-dsADN o anti-Sm tiene una especificidad cercana al 100% para el diagnóstico de lupus. Pero la sensibilidad es baja (el anti-dsADN está en solo el 60% de los pacientes y el anti-Sm en alrededor del 30%.)
En
resumen, el análisis de anticuerpos antinucleares solo se debe indicar en pacientes con afectación de múltiples sistemas orgánicos. Aunque con un resultado negativo es extremadamente improbable que los síntomas se deban a lupus, el resultado positivo es insuficiente para diagnosticar esta enfermedad.
El diagnóstico de lupus es directo cuando los pacientes consultan con una manifestación específica como artritis inflamatoria, exantema fotosensible, anemia hemolítica, trombocitopenia o nefritis o con anticuerpos específicos como los anticuerpos contra el ADNds o Sm.
El diagnóstico en pacientes que consultan con síntomas inespecíficos como artralgia o cansancio con anticuerpos antinucleares positivos y ADN anti-ds y anti-Sm negativos puede ser difícil, incluso para el especialista.
> Volvemos a nuestra paciente
Nuestra paciente no sufre artralgia. No tiene síntomas extraarticulares, como exantemas, úlceras bucales, síntomas de Síndrome de Sjogren, debilidad muscular, fenómeno de Raynaud, dolor torácico pleurítico o disnea. Su examen físico y el análisis de orina son normales.
Su médico de atención primaria solicita un hemograma completo, eritrosedimentación y concentración de tirotropina. Si bien se le aseguró que su cansancio no se debe al lupus, ella insiste en un análisis de anticuerpos antinucleares.
El hemograma completo es normal. La eritrosedimentación es 6 mm/hora. Pero la tirotropina está aumentada y las pruebas ulteriores muestran que la tiroxina libre y los anticuerpos antiperoxidasa tiroidea están disminuidos. Los anticuerpos antinucleares son positivos en el título de 1/80 y negativos para anti-dsADN and anti-ENA.
Le explicamos que lo más probable es que los anticuerpos antinucleares positivos se relacionen con su tiroiditis autoinmune y la derivamos a un endocrinólogo.
| Anticuerpos antifosfolípidos |
Viñeta clínica
Una mujer de 24 años consulta el servicio de urgencias con una trombosis venosa profunda no provocada aguda en la pierna derecha, confirmada por ecografía. No tiene antecedentes de trombosis previas y carece de antecedentes familiares importantes. Nunca estuvo embarazada. Su recuento de plaquetas es de 84 × 109/l (valores de referencia 150–400) su tiempo de tromboplastina parcialmente activada inicial está prolongado y es de 62 segundos (valores de referencia 23,0– 32,4). El resto de sus análisis, el tiempo de protrombina, las enzimas hepáticas y la creatininemia son normales.
¿Se debería indicar el análisis de anticuerpos antifosfolípidos?
Los anticuerpos antifosfolípidos son importantes debido a su asociación con el riesgo de trombosis (venosa y arterial) y de morbilidad en el embarazo. El nombre
no es apropiado, ya que estos anticuerpos actúan contra algunas proteínas que están unidas a los fosfolípidos y no a los fosfolípidos solos.
Según los criterios de Sapporo modificados para la clasificación del síndrome antifosfolipído, los anticuerpos antifofolípidos deben seguir persistentemente positivos en por lo menos 2 ocasiones separadas con por lo menos 12 semanas de intervalo para que el resultado se considere significativo, porque algunas infecciones y fármacos se pueden asociar con la presencia transitoria de estos anticuerpos.
La pesquisa sistemática de anticuerpos antifosfolípidos debe incluir el análisis para
anticuerpos anticardiolipina IgM e IgG, anticoagulante lúpico, y anticuerpos IgM e IgG anti beta-2 glucoproteína I.
> Anticuerpos anticardiolipina
Los anticuerpos anticardiolipina (aCL) pueden actuar contra la beta-2 glucoproteína I (beta-2GPI) que está unida a la cardiolipina (un fosfolípido) o solo contra la cardiolipina; el primero es más específico. Los anticuerpos dirigidos solo contra la cardiolipina habitualmente son transitorios y se asocian con infecciones y fármacos.
El resultado se considera significativo solo cuando los anticuerpos anticardiolipina están presentes con título mediano o alto (> 40 unidades IgG fosfolípido o unidades IgM fosfolípidos, o >percentilo 99).
> Anticoagulante lúpico
El anticuerpo con “actividad anticoagulante lúpica” es contra la protrombina más el fosfolípido o beta-2GPI más el fosfolípido. El análisis para esto es una prueba funcional en 3 pasos:
1. Demostración de la prolongación de una prueba de coagulación dependiente de fosfolípidos como el tiempo parcial de tromboplastina activada (TPTa). Aunque la presencia del anticoagulante lúpico se asocia con trombosis, se lo llama “anticoagulante” por la prolongación in vitro de las pruebas de coagulación dependientes de los fosfolípidos.
2. Estudio de mezcla. La prueba de coagulación dependiente de los fosfolípidos podría estar prolongada debido a la deficiencia de un factor de la coagulación o la presencia de los anticuerpos anti fosfolípidos. La diferenciación se logra mezclando el plasma del paciente con plasma normal (que tiene todos los factores de coagulación) en proporción 1:1. Si la prueba de coagulación continúa prolongada, se puede descartar la deficiencia de factores de la coagulación.
3. Agregado de un fosfolípido. Si la prolongación de la prueba de coagulación se debe a la presencia de un anticuerpo antifosfolípido, el agregado de fosfolípidos extra la corregirá.
> Anticuerpos anti beta-2 glucoproteína I (anti-beta-2GPI)
El beta-2GPI que no está unido a la cardiolipina se puede detectar efectuando análisis por separado para beta-2GPI (el análisis de la anticardiolipina solo detecta la beta-2GPI que está unida a la cardiolipina). El resultado se considera significativo si el beta-2GPI está presente con un título de mediano a alto (> percentilo 99).
Entre el 1% y 5% de personas aparentemente sanas en la población general pueden tener anticuerpos antifosfolípidos. Son habitualmente anticardiolipina con título bajo o anticuerpo anti-beta-GPI IgM no asociados con trombosis o resultados adversos del embarazo.
Por eso, el término
síndrome antifosfolípido se debe reservar para aquellas que tuvieron por lo menos un episodio de
trombosis o morbilidad en el embarazo y anticuerpos antifosfolípidos persistentes y no las que tienen anticuerpos antifosfolípidos asintomáticos o transitorios.
La
triple positividad (anticardiolipina, anticoagulante lúpico y anti-beta-2GPI) aparentemente se asocia con el riesgo máximo de trombosis, con incidencia acumulada a 10 años del 37,1% para el primer episodio trombótico y del 44,2% para la trombosis recurrente.
La asociación con trombosis es más fuerte para el anticoagulante lúpico que con los otros 2 anticuerpos. La prueba de anticoagulante lúpico positiva con un título de moderado a alto de anticardiolipina or anti-beta-2GPI IgM o IgG o sin él, constituye un perfil de alto riesgo, mientras que el título de moderado a alto de anticardiolipina o anti-beta-2GPI IgM o IgG constituye un perfil de riesgo moderado. El título bajo de anticardiolipina o anti-beta-2GPI IgM o IgG constituye un perfil de bajo riesgo que puede no estar asociado con trombosis.
Es importante reconocer el síndrome antifosfolípido debido a que estos pacientes necesitarán anticoagulación prolongada para prevenir recidivas.
Puede ser primario cuando está solo o secundario cuando está asociado con otra enfermedad autoinmune como el lupus. Los episodios venosos en el síndrome antifosfolípido se suelen manifestar como trombosis venosa de miembros inferiores o embolia pulmonar, mientras que los episodios arteriales se manifiestan como ACV o accidente isquémico transitorio.
Las manifestaciones
obstétricas pueden incluir no solo aborto espontáneo y mortinatalidad, sino también parto prematuro, retardo del crecimiento intrauterino y eclampsia, todos debido a insuficiencia placentaria.
La frecuencia de anticuerpos antifosfolípidos se estimó en el 13,5% en pacientes con ACV, el 11% con infarto del miocardio, el 5% con trombosis venosa profunda, y el 6% para las pacientes con morbilidad en el embarazo.
Cuadro 1
Algunas indicaciones para el análisis de anticuerpos antifosfolípidosTrombosis venosa profunda no provocada o embolia pulmonar (esta prueba no se recomienda en pacientes con trombosis venosa provocada, ya que no hay suficiente evidencia para recomendar la anticoagulación prolongada.)
ACV isquémico (incluyendo el accidente isquémico transitorio) en pacientes <50 años
Pacientes con episodios arteriales y venosos
Trombosis recidivante
Trombosis en algún lugar inusual
Morbilidad en el embarazo (1 o más muertes inexplicadas de un feto morfológicamente normal en la semana 10 de gestación o después; 1 o más nacimientos prematuros de un neonato morfológicamente normal antes de la semana 34 de gestación debido a preeclampsia, eclampsia, o insuficiencia placentaria o 3 o más abortos espontáneos consecutivos antes de la 10ª semana de gestación)
Todos los pacientes con lupus eritematoso sistémico |
En la paciente presentada sería apropiado el análisis para anticuerpos antifosfolípidos debido a su trombosis no provocada, trombocitopenia y prolongación del TPTa. El tratamiento anticoagulante se asocia con anticoagulante lúpico falso-positivo, de manera que las muestras de sangre se deben obtener antes de comenzar el tratamiento.
> Volvemos a nuestra paciente
El análisis de anticardiolipina IgG de nuestra paciente es negativo, mientras que su anticoagulante lúpico y su beta- 2GPI IgG son positivos. No tiene ninguna característica clínica o bioquímica que sugiera lupus.
Se inicia tratamiento con warfarina. Después de 3 meses, la warfarina se interrumpe durante varios días y se repiten las pruebas para los 3 anticuerpos antifosfolípidos. Su beta-2GPI I IgG y el anticoagulante lúpico son nuevamente positivos.
Debido a la positividad persistente de los anticuerpos antifosfolípidos y sus antecedentes de trombosis venosa profunda, se le diagnostica síndrome antifosfolípido primario. Se le aconseja continuar el tratamiento anticoagulante por tiempo indefinido.
| Anticuerpos anticitoplasma de neutrófilos |
Viñeta clínica
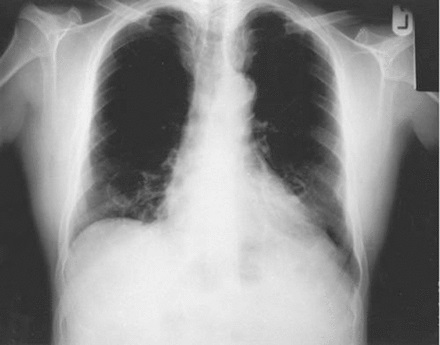
Un hombre de 34 años, usuario de drogas intravenosas, consulta por fiebre, malestar y artralgia generalizada de 2 semanas de duración. No hay síntomas de infección localizada. Los datos importantes en el examen físico son temperatura de 38,0°C, marcas de pinchazos en sus brazos, exantema vasculítico en sus piernas que no se blanquea con la presión y un soplo sistólico precordial.
Su cifra de leucocitos es 15,3 × 109/l (normal 3,7–11m0) y su proteína C reactiva es 234 mg/dl (normal < 3). Por lo demás, los resultados del hemograma completo, las enzimas hepáticas, las pruebas de función renal, el análisis de orina y la radiografía de tórax son normales.
Se extrae sangre para dos series de hemocultivos. Se solicita una ecocardiografía transtorácica y el análisis de anticuerpos anticitoplasma de neutrófilos (ANCA, por las siglas del inglés) así como pruebas de pesquisa para el VIH, la hepatitis B y la hepatitis C.
¿Estaba indicado el análisis de ANCA en este paciente?
Los ANCA son autoanticuerpos contra antígenos ubicados en los gránulos citoplasmáticos de los neutrófilos y los monocitos. Se asocian con vasculitis de los pequeños vasos como la granulomatosis con poliangitis (GPA), la poliangitis microscópica (PAM), la granulomatosis eosinofílica con poliangitis (GEPA), y la glomerulonefritis crescéntica paucinmune aislada. Colectivamente todas se conocen como vasculitis asociadas a ANCA (VAA)
Los métodos para detectar los ANCA son la inmunofluorescencia indirecta y los inmunoanálisis enzimáticos antígeno-específicos. La inmunofluorescencia indirecta solo nos dice si está presente un anticuerpo que actúa sobre un antígeno citoplasmático. Sobre la base de las características de la inmunofluorescencia indirecta, los ANCA se pueden clasificar en:
• Perinuclear o p-ANCA
• Citoplasmático o c.ANCA
• Atípico
La inmunofluorescencia indirecta
no da información sobre el antígeno contra el cual actúa; esto solo se puede obtener al efectuar uno de los inmunoanálisis antígeno-específicos. El antígeno que actúa sobre c-ANCA es habitualmente la proteinasa-3 (PR3), mientras para p-ANCA podría ser la mieloperoxidasa (MPO), la catepsina, la lisozima, la lactoferrina o el inhibidor dela permeabilidad bactericida.
El anti-PR3 es muy específico para GPA, mientras que el anti-MPO se asocia con MPA and EGPA. De ahí que hay una tendencia creciente a clasificar la vasculitis asociada a ANCA como vasculitis asociada a PR3 o a MPO en lugar de GPA, MPA, EGPA, o vasculitis con afectación renal predominante.
Varias auditorías mostraron que se abusa mucho de la prueba de ANCA y se la indica indiscriminadamente para descartar la vasculitis.
El médico debe tener en cuenta que
la prueba para ANCA se debe indicar solo si la probabilidad de vasculitis asociada a ANCA es grande. Las indicaciones propuestas por el
International Consensus Statement sobre la prueba de ANCA se enumeran en el cuadro 2.
Cuadro 2
Indicaciones clínicas para el análisis de anticuerpos anticitoplasma de neutrófilos
- Glomerulonefritis
- Hemorragia pulmonar (especialmente con el síndrome renopulmonar)
- Nódulos pulmonares múltiples
- Mononeuritis multiplex o neuropatía periférica inexplicada
- Vasculitis cutánea, especialmente con características sistémicas
- Escleritis
- Masa retroorbitaria
- Enfermedad destructiva crónica de las vías respiratorias altas
- Sinusitis u otitis crónicas
- Estenosis traqueal subglótica
|
Las guías actuales recomiendan emplear uno de los análisis antígeno-específicos para PR3 y MPO como el principal método de pesquisa.
En un gran estudio multicéntrico de Damoiseaux et al, la especificidad de los diferentes inmunoanálisis antígeno específicos fue del 98% - 99% para PR3-ANCA y del 96% - 99% para MPO-ANCA.
La vasculitis asociada a ANCA no se debe descartar si PR3 y MPO-ANCA son negativos. Si el resultado deI ANCA es negativo y hay una fuerte sospecha de vasculitis asociada a ANCA, el médico puede indicar otro método de inmunoanálisis o la inmunofluorescencia indirecta. Los resultados de esta última pueden ser positivos en aquellos pacientes con un inmunoanálisis negativo y vice versa.
El ANCA positivo no es diagnóstico de vasculitis asociada al ANCA. Otras numerosas enfermedades se asocian con ANCA, habitualmente p-ANCA o ANCA atípico. Los antígenos sobre los que actúan estos ANCA son catepsina, lisozima, lactoferrina e inhibidor de la permeabilidad bactericida.
Es por eso que el resultado del ANCA siempre se debe interpretar en el contexto del cuadro clínico completo. La biopsia todavía se debe considerar como la prueba de referencia para el diagnóstico de vasculitis asociada al ANCA. El título de ANCA puede contribuir a mejorar la interpretación clínica, debido a que la probabilidad de vasculitis asociada al ANCA aumenta con las concentraciones mayores de PR3 y MPO-ANCA.52
> Volvemos a nuestro paciente
Los hemocultivos de nuestro paciente fueron positivos para
Staphylococcus aureus sensibles a meticilina en ambas series. La ecocardiografía transtorácica revela vegetaciones alrededor de la válvula tricúspide, sin evidencias de insuficiencia valvular. El diagnóstico es endocarditis infecciosa derecha. Se le administran los antibióticos apropiados.
Los análisis para VIH, hepatitis B y hepatitis C son negativos. El análisis de ANCA es positivo para MPO-ANCA a 28 IU/ml (normal < 10).
Se cree que el ANCA positivo se relaciona con la endocarditis infecciosa. Su vasculitis es más probablemente secundaria a la endocarditis infecciosa y no es vasculitis asociada al ANCA. La indicación del análisis del ANCA no era necesaria.
| Antígeno leucocitario humano -B27 |
Viñeta clínica
Un joven de 22 años consulta a su médico de atención primaria con antecedentes de 4 meses de lumbalgia que empeoró gradualmente, asociada con rigidez al despertar, que dura más de 2 horas. No tiene síntomas en las articulaciones periféricas.
Sufrió 2 episodios de uveítis en los últimos 2 años. Su padre tiene antecedentes de espondilitis anquilosante. El examen físico revela restricción global de los movimientos lumbares y el resto sin particularidades. La resonancia magnética (RM) de la columna lumbar y las articulaciones sacroilíacas es normal.
¿Se debería efectuar a este paciente el análisis del antígeno leucocitario humano- B27 (HLA-B27)?
El complejo mayor de histocompatibilidad (CMH) es un complejo de genes presente en todos los animales, que codifica las proteínas que contribuyen a la tolerancia inmunológica. HLA se refiere a la versión humana del CMH. El complejo de genes HLA, localizado en el cromosoma 6, se clasifica en clase I, clase II y clase III.
HLA-B es uno de los 3 genes clase I. El
HLA-B27 positivo significa que ese gen está presente en esa persona.
HLA-B27 se asocia fuertemente con la espondilitis anquilosante, también llamada espondiloartropatía axial. Otros genes también contribuyen a la patogénesis de la espondilitis anquilosante, pero
HLA-B27 está presente en más del 90% de los pacientes con esta enfermedad y se lo considera el más importante.
La asociación no es tan fuerte para la espondiloartropatía periférica. Estudios señalan una frecuencia de hasta el 75% para la artritis reactiva y artritis asociada con la enfermedad intestinal inflamatoria y hasta el 50% para la artritis soriásica y la uveítis.
Alrededor del 9% de personas
sanas, asintomáticas pueden tener
HLA-B27, por lo que la sola presencia de este gen no es evidencia de enfermedad. El riesgo de sufrir espondilitis anquilosante puede estar amentado hasta 20 veces entre las personas positivas para
HLA-B27.
Algunos genes HLA tienen muchos alelos diferentes, cada uno de los cuales tiene un número (esto explica el número 27 después de la B).
Los alelos que difieren uno de otro solo por unas pocas sustituciones de aminoácidos se clasifican juntos y es así como hay más de 100 subtipos de
HLA-B27 (designados desde HLA-B*2701 a HLA-B*27106). No todos los subtipos de
HLA-B27 se asocian con enfermedad y algunos, como el HLA-B*2706, incluso puede ser protectores.
> ¿Cuándo se debe considerar hacer análisis para HLA-B27?
No todos los pacientes con lumbalgia necesitan un análisis de HLA-B27. Antes es importante buscar las características clínicas de la espondiloartropatía (Cuadro 3).
Cuadro 3
Características de la espondiloartritis
- Lumbalgia inflamatoria
- Artritis
- Entesitis del talón
- Dactilitis
- Uveítis
- Soriasis
- Enfermedad intestinal Inflamatoria
- Buena respuesta a los antiinflamatorios no esteroides
- Antecedentes familiares de espondiloartritis
- HLA-B27 positivo
- Aumento de la proteína C reactiva
|
La característica unificante de la espondiloartropatía axial es la entesitis (inflamación de los sitios de inserción de tendones o ligamentos). Esta inflamación causa espondilitis y sacroileítis, que se manifiestan como lumbalgia inflamatoria.
Las
claves clínicas de la lumbalgia inflamatoria son:
- comienzo insidioso
- empeoramiento con el reposo o la inactividad
- rigidez prolongada al despertar
- perturbaciones del sueño durante la segunda mitad de la noche
- alivio con el movimiento o la actividad
- dolor glúteo alternante (debido a sacroileítis)
- buena respuesta a los antiinflamatorios
La espondiloartropatía periférica se puede manifestar con artritis, entesitis o dactilitis.
También puede haber soriasis, enfermedad intestinal inflamatoria, antecedentes de infección gastrointestinal o genitourinaria precedente, antecedentes familiares de trastornos semejantes y antecedentes de uveítis recidivante. Para la evaluación inicial de los pacientes con lumbalgia inflamatoria, el estudio de referencia es la radiografía simple de las articulaciones sacroilíacas.
Si no aparece evidencia de sacroileitis, se debe considerar efectuar la RM de las articulaciones sacroilíacas. Mientras que la radiografía simple puede revelar solo cambios estructurales como esclerosis, erosiones y anquilosis, la RM es útil para evaluar los cambios inflamatorios tempranos, como el edema de la médula ósea. Los estudios por imágenes de la columna lumbar no son necesarios, ya que las articulaciones sacroilíacas están casi invariablemente afectadas en la espondiloartropatía.
El diagnóstico de espondilitis anquilosante antes se basaba en los estudios por imágenes, pero actualmente, según los nuevos criterios de clasificación de la
International Society, aplicables a pacientes < de 45 años con más de 3 meses de lumbalgia, los pacientes se pueden clasificar como:
• Espondiloartropatía radiográfica, si tienen evidencia de sacroileítis en los estudios por imágenes más otra característica de espondiloartropatía
• Espondiloartropatía no radiográfica si tienen
HLA-B27 positiva más otras 2 características de espondiloartropatía (Cuadro 3).
La sensibilidad de estos nuevos criterios es del 82,9% y la especificidad del 84,4%. Ante la ausencia de características en los estudios por imágenes y el HLA-B27 negativo, no se puede clasificar al paciente como enfermo de espondiloartropatía.
> Volvemos a nuestro paciente
La ausencia de evidencia radiográfica no excluiría la espondiloartropatía axial en nuestro paciente. El análisis de HLA-B27 se indica debido a la lumbalgia inflamatoria y la presencia de 2 características de la espondiloartropatía (la uveítis y los antecedentes familiares). El resultado es positivo. Su enfermedad se clasifica como espondiloartropatía axial no radiográfica.
Se lo medica con naproxeno y se los deriva a un fisioterapeuta. Después de un mes, el paciente refiere una mejoría sintomática significativa. Pregunta si se le puede volver a hacer el análisis de
HLA-B27 a fin de ver si ahora es negativo. Le explicamos que no tiene sentido repetirlo, ya que se trata de un gen y no desaparecerá.
Conclusión
> Considere el cuadro clínico
Ante el paciente con presunta enfermedad reumatológica, el médico debe considerar primero las manifestaciones clínicas y el propósito de cada análisis. Los análisis, en general, tienen varios propósitos. Pueden contribuir a:
• Aumentar la probabilidad del diagnóstico en cuestión. Por ejemplo, el factor reumatoide positivo o el factor anticuerpo antipéptido citrulinado pueden ayudar a diagnosticar la artritis reumatoide en el paciente con poliartritis incipiente, el HLAB27 positivo puede ayudar a diagnosticar la espondilitis anquilosante en pacientes con lumbalgia inflamatoria y estudios por imágenes normales, y el análisis ANCA positivo puede contribuir a diagnosticar la vasculitis asociada a ANCA en el paciente con glomerulonefritis.
• Disminuye la probabilidad del diagnóstico en cuestión. Por ejemplo, un análisis de anticuerpo antinuclear negativo disminuye la probabilidad de lupus en el paciente con dolores articulares.
• Monitorear la enfermedad. Por ejemplo los anticuerpos ADN se pueden emplear para monitorear la actividad del lupus.
• Planificar la estrategia terapéutica. Por ejemplo, se podría considerar la anticogulación de por vida si los anticuerpos antifosfolípidos son persistentemente positivos en el paciente con trombosis.
• Pronosticar. Por ejemplo, el factor reumatoide positivo y el anticuerpo antipéptido citrulinado aumentan el riego de sufrir artritis reumatoide erosiva.
Se el análisis se indicó sin una indicación clara y el resultado es positivo, es importante recordar las posibles dificultades asociadas con ese análisis y no añadir prematuramente una etiqueta diagnóstica. Ningún análisis puede confirmar o excluir una enfermedad, de modo que los resultados siempre se deben interpretar en el contexto de todo el cuadro clínico. |
Resumen y comentario objetivo: Dr. Ricardo Ferreira