| Introducción |
El pie diabético, es una complicación común y devastadora de la diabetes. Se asocia a una mala calidad de vida, tasas muy altas de amputación de miembros inferiores y mortalidad, y su manejo es costoso para los servicios de salud. Se estima que hasta una cuarta parte de los pacientes con diabetes tienen un riesgo de por vida de desarrollar pie diabético.
Desafortunadamente, incluso si se logra la curación, el 40% de los pacientes tienen una recurrencia dentro del primer año. Estas estadísticas aleccionadoras resaltan la necesidad de una atención y un manejo oportuno para prevenir las complicaciones del pie diabético. Se estima que el 85% de las amputaciones están precedidas por pie diabético y, por lo tanto, se pueden prevenir con mejoras en el cuidado de las úlceras.
| Etiología |
La etiología del pie diabético es un proceso complejo y multifactorial. Los factores de riesgo más importantes incluyen la neuropatía periférica diabética y la enfermedad vascular periférica (EVP). Otros factores de riesgo importantes incluyen factores relacionados con el paciente (p. ej., edad y comorbilidades como enfermedad renal y edema periférico), diabetes (p. ej., duración de la diabetes y control glucémico), anomalías biomecánicas (p. ej., deformidades del pie), infecciones y traumatismos (p. ej., calzado inadecuado).
La neuropatía diabética somática y autonómica es progresiva y puede dar lugar a un pie insensible, seco (anhidrótico) y deformado que presenta un alto riesgo de pie diabético. La neuropatía somática produce pérdida sensorial, lo que coloca al paciente en alto riesgo de sufrir un trauma no percibido. También puede afectar los nervios motores, lo que provoca atrofia muscular intrínseca del pie, movilidad limitada de la articulación del tobillo y deformidades posteriores del pie (p. ej., hallux valgus y dedos en garra) con carga de presión plantar elevada.
Las áreas del metatarso y del talón son particularmente vulnerables a esta carga patológica del pie. Con el tiempo, se pueden desarrollar callos (hiperqueratosis) que finalmente pueden romperse y provocar ulceración. La disfunción autonómica da como resultado una reducción de la sudoración dejando la piel seca, frágil y predispuesta a la formación de grietas y fisuras. La neuropatía autonómica también puede resultar en una alteración de la regulación microvascular y la perfusión del pie.
La enfermedad vascular periférica es una afección aterosclerótica crónica que se estima que está presente en hasta la mitad de los pacientes que presentan pie diabético. Se asocia con peor cicatrización, mayores tasas de amputación y mayor mortalidad. Los pacientes con EVP y pie diabético tienen casi el doble de riesgo de infección del pie.
| Evaluación del pie diabético |
> Historial clínico
Se debe obtener una historia clínica detallada de cada paciente que presente pie diabético. Debe incluir antecedentes del paciente, intervenciones previas, amputaciones, antigüedad del diagnóstico de diabetes, control glucémico, neuropatía periférica, tiempo de evolución de la ulceración, cambios en el aspecto de la úlcera y posibles factores precipitantes como traumatismos o calzado nuevo.
Considerar síntomas de infección sistémica (p. ej., fiebre), factores de riesgo de pie diabético, como neuropatía, síntomas de EVP (claudicación intermitente o dolor de reposo) o deformidades del pie. Sin embargo, es importante tener en cuenta que la EVP puede estar ausente, ser sutil o atípica, debido a la alteración de la retroalimentación sensorial y la propensión a sufrir una enfermedad aterosclerótica más difusa o distal.
> Examen físico
Realizar una evaluación de la herida y la presencia de lesiones potencialmente preulcerosas (p. ej., grietas, fisuras, infección micótica, uñas deformadas, espacios interdigitales macerados) y deformidades del pie, neuropatía y EVP. Se debe describir el número de úlceras, su ubicación, tamaño, profundidad, lecho de la herida, márgenes, presencia de estructuras más profundas (p. ej., tendón, hueso) y cualquier signo de infección. Las úlceras tienen diferentes características según la etiología subyacente. La palpación directa del hueso en la base de la herida plantea la posible presencia de osteomielitis. Se debe prestar especial atención a la detección de úlceras que puedan estar ocultas en los espacios interdigitales o bajo la piel callosa.
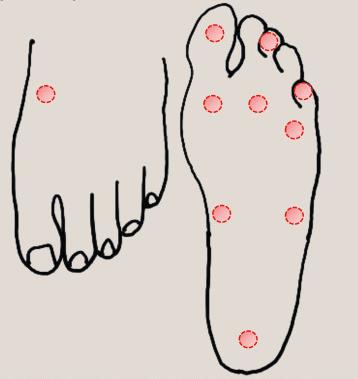
La prueba de neuropatía generalmente implica la prueba de sensibilidad usando un monofilamento de 10 g aplicado a diez sitios de prueba en el pie (ver figura). Esto se puede usar en combinación con pruebas de vibración (usando un diapasón de 128 Hz) y propiocepción en la primera articulación metatarsofalángica.
El examen vascular debe incluir una evaluación de los pulsos periféricos.
Sin embargo, es importante reconocer que el diagnóstico de EVP puede ser un desafío por la presencia de vasos calcificados e incompresibles. Aunque hay pruebas no invasivas disponibles (p. ej., índice de presión tobillo-brazo (ITB), índice de presión dedo del pie-brazo (IDB) o presión transcutánea de oxígeno (TcPO2)), se ha demostrado que el doppler del tobillo puede ser la mejor prueba para excluir la EVP en pacientes con diabetes. Independientemente, ITB e IDB deben medirse, ya que es probable que sean importantes en la estratificación del riesgo.
> Sistemas de clasificación clínica de las úlceras del pie diabético
En los últimos años, se han desarrollado y validado varios esquemas de clasificación de las úlceras del pie diabético con fines de estratificación del riesgo y para permitir una mejor comunicación entre los profesionales de la salud. El Grupo de Trabajo Internacional sobre el Pie Diabético (IWGDF) recomienda el uso del sistema SINBAD para la comunicación entre los profesionales de la salud y el sistema WIfI para la evaluación de la perfusión y el posible beneficio de la revascularización.
SINBAD (puntaje máximo = 6) | ||
Categoría | Definición | Puntaje |
Sitio | Antepié | 0 |
Mediopié y retropié | 1 | |
Isquemia | Pulso pedio intacto, al menos un pulso palpable | 0 |
Evidencia clínica de reducción del flujo sanguíneo | 1 | |
Neuropatía | Sensación protectora intacta | 0 |
Sensación protectora perdida | 1 | |
Infección bacteriana | Ausente | 0 |
Presente | 1 | |
Área | Úlcera ≤ 1cm | 0 |
Úlcera > 1cm | 1 | |
Profundidad | Úlcera confinada a la piel y tejido subcutáneo | 0 |
Úlcera que alcanza músculo, tendón o más profundidad | 1 | |
WIfI | ||||
Categoría | Definición | Puntaje | ||
Herida | Sin úlcera (dolor isquémico en reposo) | 0 | ||
Úlcera pequeña y poco profunda en la parte distal de la pierna o el pie sin gangrena | 1 | |||
Úlcera más profunda con hueso, articulación o tendón expuesto, ± cambios gangrenosos limitados a los dedos de los pies | 2 | |||
Úlcera profunda extensa, úlcera de talón de espesor total ± afectación del calcáneo ± gangrena extensa | 3 | |||
Isquemia | ABPI | Presión en el tobillo | Presión del dedo del pie o TcPO2 |
|
≥0.80 | >100 | ≥60 | 0 | |
0,60–0,79 | 70–100 | 40–59 | 2 | |
0,40–0,59 | 50–70 | 30–39 | 2 | |
<0,40 | <50 | <30 | 3 | |
Infección del pie | Sin síntomas/signos de infección | 0 | ||
Infección definida por la presencia de al menos 2 de los siguientes: •Hinchazón o induración local •Eritema (>0,5 a ≤2 cm alrededor de la úlcera) •Sensibilidad o dolor local •Calidez local •Secreción purulenta |
| |||
Infección local (como se definió anteriormente) que afecta solo la piel y el tejido subcutáneo | 1 | |||
Infección local (como se definió anteriormente) con eritema > 2 cm o estructuras más profundas que la piel/tejido subcutáneo | 2 | |||
Infección local (como se describió anteriormente) con signos de SIRS, definidos por 2 o más de los siguientes: Temperatura > 38 °C o < 36 °C Frecuencia cardíaca > 90 latidos/min Frecuencia respiratoria > 20 respiraciones/min o PaCO 2 < 32 mmHg Recuento de glóbulos blancos >12.000 o <4.000 cu/mm o 10 % de formas inmaduras (banda) | 3 | |||
Al examinar un pie caliente e hinchado en una persona con diabetes, es importante considerar siempre un diagnóstico diferencial de neuroartropatía de Charcot ("pie de Charcot"). En etapas tempranas, se presenta como una afección inflamatoria localizada de los huesos, las articulaciones y los tejidos blandos y puede diagnosticarse erróneamente como celulitis o gota. La deformidad clásica asociada con las etapas posteriores de esta afección es el colapso del mediopié ("pie en mecedora") que crea presiones plantares altas en el mediopié y el pie diabético subsiguiente (Figura).

Figura. Radiografías de pie diabético. (a) Radiografía lateral de una deformidad en mecedora del pie de Charcot. Tenga en cuenta que hay un colapso del arco y un calcáneo rotado. (b) Radiografía del pie de Charcot con fractura- luxación de Lisfranc . Obsérvese que existe un desplazamiento lateral de los metatarsianos menores con respecto al 1.er metatarsiano y una diástasis significativa entre el 1.er y 2.º metatarsianos. También se observa una fractura transversal en la base del segundo metatarsiano derecho. Estos hallazgos son compatibles con una luxación por fractura de Lisfranc. (c) Gas subcutáneo observado en una radiografía de un paciente con sepsis del pie diabético (flecha roja).
> Análisis de laboratorio
Un recuento celular completo, PCR, función renal y hemoglobina glicosilada (HbA1c) pueden ser de interés. Un recuento elevado de neutrófilos y PCR pueden sugerir la presencia de una infección. El nivel de procalcitonina puede ser útil para determinar la presencia y la gravedad de una infección bacteriana, así como para monitorear la efectividad del tratamiento a lo largo del tiempo. La anemia puede afectar el potencial de cicatrización de heridas y debe corregirse.
> Estudios por imágenes
Las radiografías pueden ser útiles para identificar deformidades óseas, cuerpos extraños, osteomielitis o gas subcutáneo en el tejido blando si se sospecha una infección. Es posible que se necesiten imágenes adicionales, como resonancia magnética (RMN), para evaluar la presencia de osteomielitis o una colección más profunda, mientras que la ecografía también puede ser útil con respecto a este último.
Si se sospecha EVP en un paciente con pie diabético activo, se requieren imágenes arteriales tempranas para confirmar el diagnóstico y planificar la revascularización. Las imágenes de primera línea suelen ser ecografías doppler arteriales completas de las extremidades inferiores. Las imágenes de segunda línea pueden incluir angiografía por tomografía computarizada (angioTAC), angiografía por resonancia magnética o angiografía por sustracción digital (ASD).
> Microbiología
Las características clínicas de la infección incluyen eritema, calor, hinchazón, secreción purulenta y dolor. Aunque el dolor puede no ser una característica común en pacientes con neuropatía periférica, su presencia puede indicar la presencia de una colección más profunda que justifique más estudios.
Las muestras superficiales generalmente no son útiles, ya que identifican microorganismos que pueden no ser verdaderamente representativos. Por lo tanto, las muestras más profundas recolectadas por curetaje o biopsia son preferibles cuando sea posible. El diagnóstico definitivo de osteomielitis requiere el cultivo de muestras de hueso. Los microorganismos infecciosos comunes incluyen estafilococos, estreptococos y bacterias anaerobias.
| Manejo del pie diabético |
> Prevención del pie diabético y complicaciones cardiovasculares de la diabetes
La prevención de ulceraciones nuevas y recurrentes es una prioridad clave. El NICE recomienda que todos los pacientes con diabetes se sometan al menos a un control anual de pies, oportunidad importante para evaluar el riesgo de ulceración, modificar los factores de riesgo y brindar educación al paciente. A los pacientes de riesgo moderado o alto de ulceración se les puede ofrecer controles más frecuentes (3 a 4 veces al año).
La modificación de los factores de riesgo cardiovascular se personaliza según el individuo, pero puede incluir el cese tabáquico, control de la glucemia, tratamiento antiplaquetario y el tratamiento de la hipertensión y la dislipidemia. Se debe informar a los pacientes sobre su riesgo actual de desarrollar pie diabético, cuándo buscar ayuda en caso de una emergencia, la importancia de las revisiones diarias de los pies y consejos generales sobre el cuidado de los mismos.
Los consejos para el cuidado de los pies deben incluir el lavado diario de los pies, seguido de un secado cuidadoso de los pies (especialmente entre los dedos), humectación de los pies (pero no entre los dedos), evitar caminar descalzo, usar calcetines con zapatos, usar zapatos apropiados, revisar el interior de los zapatos para objetos extraños antes de usarlos y cortar las uñas en línea recta.
> Manejo de la sepsis del pie diabético
La infección local del pie diabético con signos de respuesta inflamatoria sistémica (p. ej., temperatura >38 °C o <36 °C, taquicardia y aumento de la frecuencia respiratoria) sugiere un diagnóstico de infección grave o sepsis. Se debe mantener un alto índice de sospecha ya que los retrasos en el tratamiento se asocian con un alto riesgo de morbilidad y mortalidad.
La administración de antibióticos y líquidos intravenosos no debe retrasarse. Las alteraciones metabólicas, incluidos los desequilibrios electrolíticos, la acidosis y la hiperglucemia, deben corregirse rápidamente. Además, el desbridamiento quirúrgico de emergencia para controlar la fuente de sepsis es fundamental.
> Manejo de las heridas del pie diabético
La prevención y el manejo del pie diabético requieren una atención multidisciplinaria bien coordinada, que incluyan podólogos con experiencia en la evaluación y el manejo del pie diabético.
El manejo debe ser holístico y considerar la úlcera como un signo de enfermedad multiorgánica. Los equipos interdisciplinarios bien organizados pueden incluir miembros de varias especialidades: cirugía vascular, traumatología, podología, enfermería, entre otras.
Aunque la mayoría de los pacientes con pie diabético pueden tratarse de forma eficaz en el ámbito ambulatorio, requieren un tratamiento intensivo, aunque los pacientes pueden requerir atención hospitalaria (infección grave, fracaso del tratamiento ambulatorio y/o necesidad de un procedimiento quirúrgico.
Tratamiento de la infección: la infección está presente en hasta la mitad de los pacientes con pie diabético y está fuertemente asociada con un mayor riesgo de hospitalización, amputación y mortalidad. Una infección del pie diabético se define por la presencia de al menos dos de los signos clásicos de infección. Otros signos secundarios pueden incluir una herida maloliente y tejido de granulación friable.
La infección del pie diabético puede progresar rápidamente, por lo tanto, si se sospecha clínicamente una infección, se debe iniciar inmediatamente una terapia con antibióticos de amplio espectro. La elección de éstos dependerá de los protocolos locales y, de estar disponibles, de los resultados de cultivos recientes.
La respuesta al tratamiento debe revisarse regularmente y los antibióticos deben cambiarse de acuerdo con las sensibilidades lo antes posible. La duración requerida de la terapia con antibióticos suele ser de 10 a 14 días para infecciones de tejidos blandos, o de 6 a 8 semanas para osteomielitis (Figura). El ensayo reciente OVIVA (antibióticos orales versus intravenosos) demostró resultados equívocos entre los antibióticos orales e intravenosos para infecciones complejas de huesos y articulaciones.

Figura. Ulceración del pie diabético. (a) Úlcera de pie diabético en la cara lateral del pie derecho. (b) Radiografía de la misma úlcera que demuestra osteomielitis de la cabeza del quinto metatarsiano (flecha roja). También se hace nota de vasos pedales calcificados.
El tratamiento de la infección también suele requerir algún tipo de tratamiento quirúrgico para controlar la infección y establecer un lecho sano de la herida. Esto puede variar desde el desbridamiento hasta una resección más extensa de tejido. Datos recientes sugieren que la osteomielitis no complicada puede tratarse de manera conservadora con un curso prolongado (6 a 8 semanas) de antibióticos orales sin necesidad de cirugía. Sin embargo, es menos probable que este enfoque más conservador sea efectivo en presencia de EVP, enfermedad renal en etapa terminal, infección grave, organismos resistentes e infección necrosante de tejidos blandos o huesos.
Descarga: Las lesiones repetitivas causadas por la alta presión y las fuerzas de cizallamiento impiden la cicatrización del pie diabético. La descarga es fundamental en el manejo del pie diabético y se refiere al uso de dispositivos o cirugía para aliviar esta presión y facilitar la cicatrización de heridas. Estos incluyen calzado terapéutico y plantillas personalizadas, apósitos acolchados, separadores de dedos, yesos de contacto total. Los yesos de contacto total siguen siendo el estándar de oro para la descarga.
La cirugía del pie para la descarga incluye el alargamiento del tendón del calcáneo en personas con ulceración de la cabeza del metatarsiano y tenotomía flexora para dedos en garra con ulceración interfalángica apical y/o dorsal.
Atención de úlceras locales: el desbridamiento es la eliminación de tejido no viable o contaminado que puede servir como reservorio de infección o impedir el crecimiento normal del tejido. El desbridamiento es un componente esencial del tratamiento de las heridas agudas y crónicas del pie diabético.
El desbridamiento quirúrgico menor se puede realizar al lado de la cama sin el uso de anestesia local, en el paciente neuropático insensible, si no hay riesgo de sangrado mayor e implica el uso de curetas, bisturí o tijeras para raspar o diseccionar con precisión el tejido no viable y el coágulo proteínico en la superficie de la herida. El sangrado se puede controlar con presión directa.
Se prefiere el desbridamiento quirúrgico mayor, llevado a cabo en un quirófano, en los casos en que se requiere un desbridamiento más extenso, por ejemplo, en casos de colecciones profundas o infecciones de tejidos blandos, presentaciones agudas de sepsis del pie diabético o cuando se prevé un sangrado significativo. En presencia de isquemia e infección grave, como la sepsis del pie diabético, se debe realizar un desbridamiento de emergencia sin demora para evitar la rápida propagación de la infección. Después, se deben realizar imágenes vasculares urgentes y revascularización si es necesario.
El principio general del desbridamiento quirúrgico del pie es dejar solo tejido sano.
Si el tejido no está claramente delimitado, la incisión se puede iniciar en el medio de la herida y extenderse hasta alcanzar el tejido sangrante viable para identificar un borde potencialmente sano. El desbridamiento siempre debe ir seguido de una irrigación generosa para reducir la carga bacteriana y los desechos.
Las técnicas de desbridamiento biológico incluyen apósitos autolíticos, ungüentos enzimáticos, agentes osmóticos y terapia larval. Trabajan lentamente, pero son útiles para heridas con áreas pequeñas de tejido no viable, particularmente aquellas que son difíciles de desbridar quirúrgicamente. Los apósitos autolíticos (hidrogeles, hidrocoloides, alginatos e hidrofibras) promueven la liberación de enzimas proteolíticas endógenas para disolver el tejido esfacelado o necrótico. Los ungüentos enzimáticos (p. ej., colagenasa) contienen enzimas proteolíticas que alteran selectivamente el tejido desvitalizado y funcionan mejor en heridas húmedas o fibróticas.
El desbridamiento osmótico (miel) funciona extrayendo líquido del tejido sano para facilitar el desbridamiento autolítico endógeno. La terapia con larvas (también conocida como terapia de desbridamiento de gusanos) consiste en colocar gusanos vivos irradiados sobre la úlcera durante 3 a 5 días, ya sea sueltos o alojados en una bolsa biológica. Los gusanos digieren el tejido necrótico y no viable y secretan un compuesto antibacteriano que reduce la carga biológica de la herida al mismo tiempo que reduce la inflamación y facilita la remodelación del tejido. Después del desbridamiento, se puede lograr el cierre primario, secundario o terciario de la herida según la ubicación y el área de la herida.
Revascularización: en el contexto del pie diabético, el objetivo principal de la revascularización es restablecer el flujo sanguíneo y la perfusión para mejorar las posibilidades de cicatrización de heridas. La Sociedad Vascular de Gran Bretaña e Irlanda (VSGBI) recomienda que los pacientes ambulatorios con isquemia crónica que amenaza las extremidades deben ser revascularizados dentro de las 2 semanas posteriores a la derivación, mientras que los pacientes hospitalizados deben ser revascularizados dentro de los 5 días.
Hay dos enfoques principales para la revascularización: revascularización quirúrgica abierta o endovascular. Estos dos enfoques también se pueden usar en combinación en procedimientos híbridos. Esta elección debe personalizarse para el paciente y se basa en la evaluación de una serie de factores que incluyen el patrón anatómico de la enfermedad, la demanda metabólica de la herida, el riesgo específico del paciente y la preferencia.
Amputación: La toma de decisiones con respecto a cuándo amputar y a qué nivel puede ser un desafío. Aunque las amputaciones son un resultado no deseado y devastador, permiten la eliminación de tejido no viable e infectado. Una decisión temprana e informada de proceder con una amputación mayor apoyada por un equipo multidisciplinario tiene el potencial de reducir el tiempo y el deterioro del paciente que puede estar asociado con los esfuerzos prolongados para salvar la extremidad.
La amputación puede dar como resultado una mejora en la calidad de vida, particularmente en pacientes inmóviles que sufren heridas recurrentes que no cicatrizan asociadas con ingresos hospitalarios prolongados, visitas frecuentes al hospital, cambios regulares de vendajes y ciclos prolongados de antibióticos requeridos para el tratamiento de organismos resistentes.
Las amputaciones se pueden clasificar en menores (por debajo del nivel del tobillo) o mayores (por encima del nivel del tobillo). La amputación mayor de miembros inferiores está indicada en pacientes que no tienen más opciones de tratamiento. Las amputaciones por debajo o a través de la rodilla tienen la ventaja de una mayor movilidad con prótesis, mientras que la amputación por encima de la rodilla es una operación más rápida de realizar con tasas más altas de curación.
Las amputaciones menores (p. ej., amputaciones parciales/completas del radio y transmetatarsianas) son elementos importantes del tratamiento del pie diabético que se llevan a cabo como parte de los procedimientos de desbridamiento mayores. Los pacientes con gangrena digital seca, bien delimitada y de volumen limitado pueden tratarse de manera conservadora mientras se espera la autoamputación si no hay evidencia de infección o dolor.
En pacientes inestables con sepsis de pie diabético, una estrategia más apropiada puede ser realizar una amputación rápida en guillotina del tejido infectado y regresar al quirófano una vez que esté estable para convertirlo en una amputación formal.
| Puntos prácticos • Los controles de rutina del pie diabético son importantes en la prevención de la ulceración y las complicaciones cardiovasculares, ya que brindan la oportunidad de evaluar el riesgo, modificar los factores de riesgo y brindar educación al paciente. • Siempre se debe sospechar un diagnóstico de osteoartropatía neuropática de Charcot en un individuo con diabetes que presenta un pie caliente e hinchado. • En un paciente con ulceración del pie diabético, el diagnóstico oportuno de enfermedad arterial periférica y la revascularización posterior son determinantes importantes de la cicatrización de la úlcera. |
| Conclusión |
El pie diabético es una complicación compleja y devastadora de la diabetes. La prevención de complicaciones nuevas o recurrentes del pie diabético es una prioridad clave, que solo se puede lograr a través de exámenes regulares de los pies y la estratificación del riesgo con la modificación adecuada de los factores de riesgo y la educación del paciente.
Las complicaciones del pie pueden ser difíciles de manejar. Un aspecto importante del manejo incluye el diagnóstico temprano, la atención multidisciplinaria bien coordinada, el tratamiento oportuno de la infección y la enfermedad arterial periférica, así como el cuidado y descarga óptimos de la herida.