Uso racional de antibióticos
Estrategias para minimizar la resistencia a los antibióticos y maximiza su eficaciaAutor: Cheston B. Cunha, MD*, Steven M. Opal. Med Clin N Am 102 (2018) 831–843
Una preocupación importante de los programas de administración de antibióticos es la selección del tratamiento antibiótico empírico para la sepsis en el paciente hospitalizado. Aunque la definición de la sepsis continúa evolucionando, los programas de administración de antibiticos necesitan optimizar el tratamiento a la vez que minimizan la resistencia.
El tratamiento de elección para el shock séptico actualmente recomendado es la administración de antibióticos de amplio espectro empíricos, preferentemente dentro de la primera hora del reconocimiento del shock séptico.
En el paciente séptico es difícil hacer una correcta selección del antibiótico para atacar el patógeno más probable relacionado con el sitio de la infección, y minimizar la resistencia.
Obtener el máximo de efectividad de los antibióticos depende de consideraciones farmacocinéticas y farmacodinámicas. La resistencia potencial a los antibióticos, que es una característica antibiótica inherente, es independiente de la clase del antibiótico.
Dentro de cada clase de antibióticos hay agentes de bajo y alto potencial de resistencia. Las consideraciones farmacocinéticas y farmacodinámicas optimizan la efectividad, ya que la selección de un antibiótico de bajo potencial de resistencia minimiza el potencial de resistencia.
En los hospitales donde es común que microorganismos bacilares gramnegativos endémicos sean resistentes a los antibióticos, las opciones de antibióticos son limitadas, siendo muy importante elegir cuidadosamente el régimen antimicrobiano inicial para el paciente séptico.
Los mecanismos de acción e inactivación/resistencia no explican por qué los antibióticos en una clase tienen un potencial de resistencia elevado o bajo. Incluso con un volumen de uso elevado o un uso prolongado, los antibióticos con un bajo potencial de resistencia tienen poca o ninguna resistencia, por ejemplo, la ceftriaxona.
Entre las cefalosporinas de tercera generación, solo la ceftazidima, un antibiótico con un potencial de resistencia elevado, ha sido asociada con resistencia de Pseudomonas aeruginosa, incluso con un uso modesto.
Por el contrario, otras cefalosporinas de tercera generación tienen bajo potencial de resistencia y un potencial de resistencia mínimo, incluso con un elevado volumen de uso durante largos períodos de tiempo. Junto al potencial de resistencia antibiótica inherente, la misma dosificación de antibióticos está relacionada, en parte, con la aparición de resistencia.
> Pruebas de sensibilidad in vitro frente a la eficacia in vivo
La resistencia a los antibióticos es un concepto complejo. No hay acuerdo internacional sobre los puntos de corte estándar que definen cuáles son los patógenos resistentes y los sensibles a agentes específicos. Las pruebas de sensibilidad se basan en las concentraciones séricas alcanzables mediante el uso de las dosis habituales de los antibióticos recomendados.
Las pruebas de sensibilidad se utilizan para los organismos en crecimiento y, por esta razón, estas pruebas no se realizan para los organismos de crecimiento rápido. La sensibilidad de aislados cultivados de sitios no sanguíneos requiere interpretación y extrapolación.
La prueba de sensibilidad in vitro supone que el antibiótico se usa en la dosis habitual para tratar una infección del torrente sanguíneo, y que las condiciones locales en el sitio real de la infección son similares a las de la sangre.
El paciente séptico puede estar acidótico, pero las pruebas de sensibilidad de laboratorio se realizan a un pH de 7,4. La composición química de los medios de sensibilidad también afecta los resultados. Con algunos organismos, las pruebas de sensibilidad in vitro no predicen la eficacia clínica in vivo.
En general, si un organismo es reportado como sensible, usualmente los es, dependiendo del organismo y de las concentraciones séricas que se alcanzan clínicamente.
Sin embargo, hay sitios de infección importantes que no son de la sangre y que son difíciles de penetrar, requiriendo una estimación farmacocinética de las concentraciones del antibiótico en el tejido diana/sitio de la infección.
La mayoría de las veces, el antibiograma informa sensible o resistente, pero para algunos casos, por ejemplo, la penicilina y Streptococcus Pneumoniae, se informan 3 puntos de corte diferentes: sensible, intermedio y resistente. Estos puntos de corte también difieren para S. pneumoniae aislado del líquido cefalorraquídeo y el aislado de otros sitios diferentes.
La cefepima también tiene 3 puntos de corte para P. aeruginosa. En tales casos, la pregunta es si la susceptibilidad intermedia se considera como sensible o resistente. En general, si la concentración sérica alcanzable con la dosificación normal o alta excede la concentración inhibitoria mínima (CIM) del organismo intermedio o aun moderadamente resistente (en el sitio de la infección), entonces los aislados deben ser considerados como sensibles y no como resistentes.
Este punto es importante, porque muchos médicos consideran los resultados de la susceptibilidad como absolutos y no toman en cuenta las diferencias en las concentraciones de antibióticos en ausencia o presencia de inflamación/infección en diferentes sitios del cuerpo, por ejemplo, líquido cefalorraquídeo, hueso, próstata u orina.
> Resistencia natural o inherente
La resistencia puede ser clasificada por el mecanismo o tipo de resistencia, pero no explica las diferencias importantes en el potencial de resistencia de las diferentes clases de antibióticos. La resistencia a los antibióticos puede ser considerada como intrínseca o adquirida y también puede ser clasificada dentro de una clase o como resistencia cruzada entr
La resistencia antibiótica inherente es la resistencia natural de ciertos organismos, por ejemplo, los enterococos son intrínsecamente resistentes a las cefalosporinas, la P. aeruginosa demuestra una resistencia inherente a la nafacilina, y así otros.
> Resistencia adquirida
La resistencia de nivel alto/absoluta no se puede superar aumentando la dosis de antibióticos, es decir, la resistencia es independiente de las concentraciones séricas. Ante un elevado nivel de resistencia se debe seleccionar un antibiótico alternativo que sea efectivo contra el organismo.
Del mismo modo, la resistencia de alto nivel adquirida, por ejemplo, la infección por P. aeruginosa con resistencia de alto nivel adquirida que ha sido tratada con un MIC >4000 mg/ml debe tratarse con otra clase de antibiótico al cual el organismo sea sensible.
La resistencia adquirida brinda al clínico la oportunidad de aplicar los principios de farmacocinética para tratar las infecciones en diferentes sitios corporales. Estas estimaciones están basadas en principios farmacocinéticos perol os datos son limitados o no están disponibles para lograr un tratamiento individualizado.
> Resistencia de clase
La resistencia también puede considerarse dentro de una clase de antibióticos. Por ejemplo, P. aeruginosa resistente a la ciprofloxacina también puede ser resistente a la levofloxacina. Esta es una realidad clínica comúnmente reconocida, pero hay excepciones importantes, como los aminoglucósidos.
Por ejemplo, no es infrecuente que P. aeruginosa sea resistente a la gentamicina y la tobramicina, pero sensible a la amikacina. La gentamicina y la tobramicina tienen 6 loci en su estructura que las hace sensibles a las enzimas que inactivan a los aminoglucósidos, mediadoras de la resistencia clínica.
Al contrario, la amikacina tiene uno solo de esos loci. Por esta razón, la amikacina es el aminoglucósido que tiene más posibilidad de actuar contra P. aeruginosa resistente a la gentamicina y la tobramicina.
> Resistencia cruzada
Al contrario, la resistencia cruzada se refiere a la resistencia a los antibióticos de diferentes clases. Por razones que no son del todo claras, un antibiótico puede inducir resistencia en otra clase de antibiótico, con ≥1 organismos que se manifiestan por un aumento de las CIM, es decir, la “CIM con arrastre”.
Estos problemas a menudo están relacionados con mutantes de permeabilidad o con la presencia de bombas inespecíficas de eflujo que expulsan múltiples clases de antibióticos fuera de la célula.
Por ejemplo, el uso de ciprofloxacina para P. aeruginosa puede inducir CIM con arrastre, que afecta a otros fármacos antipseudomonas dentro de la misma clase, por ejemplo, la levofloxacina, así como a otras clases de antibióticos, (imipenem ceftazidima).
Lo mismo vale para otros antibióticos antipseudomonas de alto potencial de resistencia. Si el imipenem es el principal carbapenem del hospital, entonces la CIM con arrastre puede observarse con otros carbapenems, como el meropenem y el doripenem, así como en otras clases de antibióticos antipseudomonas, como ciprofloxacina, levofloxacina, gentamicina y ceftazidima.
Por esta razón, si una institución tiene un problema de resistencia con un organismo en particular, como P. aeruginosa, una única sustitución en el formulario, de un antibiótico de elevado potencial de resistencia por otro de bajo potencial de resistencia no resolverá el problema.
Para un mejor control de un problema de resistencia de P. aeruginosa, todos los antibióticos antipseudomonas del formulario deben ser de la variedad de bajo potencial de resistencia.
> Potencial de resistencia
Los antibióticos pueden ser clasificados en los que tienen un alto potencial de resistencia o un bajo potencial de resistencia. Históricamente, un antibiótico conbajo potencial de resistencia puede definirse como el que tiene poca propensión al desarrollo de resistencia, independientemente del volumen y duración de su uso, por ejemplo, doxiciclina, minociclina, amikacina o cefepima.
En contraste, es probable que los antibióticos de alto potencial de resistenciase asocien con problemas de resistencia, incluso con un volumen limitado de uso. No se sabe por qué, dentro de cada clases de antibióticos, hay algunos con alto potencial de resistencia. Y otros con bajo potencial de resistencia. Algunos miembros de cada clase de antibióticos no han causado resistencia, mientras que otros sí.
La cefalosporina de tercera generación ceftriaxona es un ejemplo de un antibiótico con bajo potencial de resistencia que, incluso después de décadas de ser usada en gran volumen, muestra muy poca resistencia clínicamente significativa u. Otra cefalosporina de tercera generación, la ceftriaxona, es el único antibiótico con alto potencial de resistencia que se asocia con P. aeruginosaresistente.
Entre las fluoroquinolonas, la ciprofloxacina es la quinolona con alto potencial de resistencia, mientras que la levofloxacina y la moxifloxacina son antibióticos con bajo potencial de resistencia.
Aunque las consideraciones farmacodinámicas pueden minimizar el potencial de resistencia de los antibióticos con alto potencial de resistencia, el mejor enfoque es preferir los antibióticos con bajo potencial de resistencia.
Puede desarrollarse resistencia si el contexto clínico es incorrecto, por ejemplo, al tratar un absceso incluso con un antibiótico de bajo potencial de resistencia, ya que dentro del absceso, las concentraciones que se logran son bajas y pueden predisponer a la resistencia.
Los patógenos que son activos en forma intermitente, que viven en un biofilm cubriendo la superficie de un cuerpo extraño, crean un ambiente ideal para la aparición de resistencia. En situaciones donde hay un flujo sanguíneo deteriorado o problemas de mala penetración tisular, puede ocurrir resistencia con cualquier antibiótico, pero ciertamente es más frecuente con los antibióticos con alto potencial de resistencia.
Un esfuerzo adicional para limitar la resistencia es aplicar el tratamiento durante el menor lapso posible que la infección permita. Los cursos más largos no son más eficaces y pueden predisponer a la resistencia.
El tratamiento de elección para el shock séptico actualmente recomendado es la administración de antibióticos de amplio espectro empíricos, preferentemente dentro de la primera hora del reconocimiento del shock séptico.
En el paciente séptico es difícil hacer una correcta selección del antibiótico para atacar el patógeno más probable relacionado con el sitio de la infección, y minimizar la resistencia.
Obtener el máximo de efectividad de los antibióticos depende de consideraciones farmacocinéticas y farmacodinámicas. La resistencia potencial a los antibióticos, que es una característica antibiótica inherente, es independiente de la clase del antibiótico.
Dentro de cada clase de antibióticos hay agentes de bajo y alto potencial de resistencia. Las consideraciones farmacocinéticas y farmacodinámicas optimizan la efectividad, ya que la selección de un antibiótico de bajo potencial de resistencia minimiza el potencial de resistencia.
En los hospitales donde es común que microorganismos bacilares gramnegativos endémicos sean resistentes a los antibióticos, las opciones de antibióticos son limitadas, siendo muy importante elegir cuidadosamente el régimen antimicrobiano inicial para el paciente séptico.
Los mecanismos de acción e inactivación/resistencia no explican por qué los antibióticos en una clase tienen un potencial de resistencia elevado o bajo. Incluso con un volumen de uso elevado o un uso prolongado, los antibióticos con un bajo potencial de resistencia tienen poca o ninguna resistencia, por ejemplo, la ceftriaxona.
Entre las cefalosporinas de tercera generación, solo la ceftazidima, un antibiótico con un potencial de resistencia elevado, ha sido asociada con resistencia de Pseudomonas aeruginosa, incluso con un uso modesto.
Por el contrario, otras cefalosporinas de tercera generación tienen bajo potencial de resistencia y un potencial de resistencia mínimo, incluso con un elevado volumen de uso durante largos períodos de tiempo. Junto al potencial de resistencia antibiótica inherente, la misma dosificación de antibióticos está relacionada, en parte, con la aparición de resistencia.
| Resistencia antibiótica |
La resistencia a los antibióticos es un concepto complejo. No hay acuerdo internacional sobre los puntos de corte estándar que definen cuáles son los patógenos resistentes y los sensibles a agentes específicos. Las pruebas de sensibilidad se basan en las concentraciones séricas alcanzables mediante el uso de las dosis habituales de los antibióticos recomendados.
Las pruebas de sensibilidad se utilizan para los organismos en crecimiento y, por esta razón, estas pruebas no se realizan para los organismos de crecimiento rápido. La sensibilidad de aislados cultivados de sitios no sanguíneos requiere interpretación y extrapolación.
La prueba de sensibilidad in vitro supone que el antibiótico se usa en la dosis habitual para tratar una infección del torrente sanguíneo, y que las condiciones locales en el sitio real de la infección son similares a las de la sangre.
El paciente séptico puede estar acidótico, pero las pruebas de sensibilidad de laboratorio se realizan a un pH de 7,4. La composición química de los medios de sensibilidad también afecta los resultados. Con algunos organismos, las pruebas de sensibilidad in vitro no predicen la eficacia clínica in vivo.
|
Sin embargo, hay sitios de infección importantes que no son de la sangre y que son difíciles de penetrar, requiriendo una estimación farmacocinética de las concentraciones del antibiótico en el tejido diana/sitio de la infección.
La mayoría de las veces, el antibiograma informa sensible o resistente, pero para algunos casos, por ejemplo, la penicilina y Streptococcus Pneumoniae, se informan 3 puntos de corte diferentes: sensible, intermedio y resistente. Estos puntos de corte también difieren para S. pneumoniae aislado del líquido cefalorraquídeo y el aislado de otros sitios diferentes.
La cefepima también tiene 3 puntos de corte para P. aeruginosa. En tales casos, la pregunta es si la susceptibilidad intermedia se considera como sensible o resistente. En general, si la concentración sérica alcanzable con la dosificación normal o alta excede la concentración inhibitoria mínima (CIM) del organismo intermedio o aun moderadamente resistente (en el sitio de la infección), entonces los aislados deben ser considerados como sensibles y no como resistentes.
Este punto es importante, porque muchos médicos consideran los resultados de la susceptibilidad como absolutos y no toman en cuenta las diferencias en las concentraciones de antibióticos en ausencia o presencia de inflamación/infección en diferentes sitios del cuerpo, por ejemplo, líquido cefalorraquídeo, hueso, próstata u orina.
| Tipos de resistencia clínicamente pertinentes |
La resistencia puede ser clasificada por el mecanismo o tipo de resistencia, pero no explica las diferencias importantes en el potencial de resistencia de las diferentes clases de antibióticos. La resistencia a los antibióticos puede ser considerada como intrínseca o adquirida y también puede ser clasificada dentro de una clase o como resistencia cruzada entr
La resistencia antibiótica inherente es la resistencia natural de ciertos organismos, por ejemplo, los enterococos son intrínsecamente resistentes a las cefalosporinas, la P. aeruginosa demuestra una resistencia inherente a la nafacilina, y así otros.
> Resistencia adquirida
La resistencia de nivel alto/absoluta no se puede superar aumentando la dosis de antibióticosLo opuesto a la resistencia natural es la resistencia adquirida, que se refiere a los organismos que antes eran sensibles a varios antibióticos pero se han vuelto resistentes. La resistencia adquirida puede ser absoluta o relativa, de nivel alto o bajo.
La resistencia de nivel alto/absoluta no se puede superar aumentando la dosis de antibióticos, es decir, la resistencia es independiente de las concentraciones séricas. Ante un elevado nivel de resistencia se debe seleccionar un antibiótico alternativo que sea efectivo contra el organismo.
Del mismo modo, la resistencia de alto nivel adquirida, por ejemplo, la infección por P. aeruginosa con resistencia de alto nivel adquirida que ha sido tratada con un MIC >4000 mg/ml debe tratarse con otra clase de antibiótico al cual el organismo sea sensible.
La resistencia adquirida brinda al clínico la oportunidad de aplicar los principios de farmacocinética para tratar las infecciones en diferentes sitios corporales. Estas estimaciones están basadas en principios farmacocinéticos perol os datos son limitados o no están disponibles para lograr un tratamiento individualizado.
> Resistencia de clase
La resistencia también puede considerarse dentro de una clase de antibióticos. Por ejemplo, P. aeruginosa resistente a la ciprofloxacina también puede ser resistente a la levofloxacina. Esta es una realidad clínica comúnmente reconocida, pero hay excepciones importantes, como los aminoglucósidos.
Por ejemplo, no es infrecuente que P. aeruginosa sea resistente a la gentamicina y la tobramicina, pero sensible a la amikacina. La gentamicina y la tobramicina tienen 6 loci en su estructura que las hace sensibles a las enzimas que inactivan a los aminoglucósidos, mediadoras de la resistencia clínica.
Al contrario, la amikacina tiene uno solo de esos loci. Por esta razón, la amikacina es el aminoglucósido que tiene más posibilidad de actuar contra P. aeruginosa resistente a la gentamicina y la tobramicina.
> Resistencia cruzada
Al contrario, la resistencia cruzada se refiere a la resistencia a los antibióticos de diferentes clases. Por razones que no son del todo claras, un antibiótico puede inducir resistencia en otra clase de antibiótico, con ≥1 organismos que se manifiestan por un aumento de las CIM, es decir, la “CIM con arrastre”.
Estos problemas a menudo están relacionados con mutantes de permeabilidad o con la presencia de bombas inespecíficas de eflujo que expulsan múltiples clases de antibióticos fuera de la célula.
Por ejemplo, el uso de ciprofloxacina para P. aeruginosa puede inducir CIM con arrastre, que afecta a otros fármacos antipseudomonas dentro de la misma clase, por ejemplo, la levofloxacina, así como a otras clases de antibióticos, (imipenem ceftazidima).
Lo mismo vale para otros antibióticos antipseudomonas de alto potencial de resistencia. Si el imipenem es el principal carbapenem del hospital, entonces la CIM con arrastre puede observarse con otros carbapenems, como el meropenem y el doripenem, así como en otras clases de antibióticos antipseudomonas, como ciprofloxacina, levofloxacina, gentamicina y ceftazidima.
Por esta razón, si una institución tiene un problema de resistencia con un organismo en particular, como P. aeruginosa, una única sustitución en el formulario, de un antibiótico de elevado potencial de resistencia por otro de bajo potencial de resistencia no resolverá el problema.
Para un mejor control de un problema de resistencia de P. aeruginosa, todos los antibióticos antipseudomonas del formulario deben ser de la variedad de bajo potencial de resistencia.
> Potencial de resistencia
Los antibióticos pueden ser clasificados en los que tienen un alto potencial de resistencia o un bajo potencial de resistencia. Históricamente, un antibiótico conbajo potencial de resistencia puede definirse como el que tiene poca propensión al desarrollo de resistencia, independientemente del volumen y duración de su uso, por ejemplo, doxiciclina, minociclina, amikacina o cefepima.
En contraste, es probable que los antibióticos de alto potencial de resistenciase asocien con problemas de resistencia, incluso con un volumen limitado de uso. No se sabe por qué, dentro de cada clases de antibióticos, hay algunos con alto potencial de resistencia. Y otros con bajo potencial de resistencia. Algunos miembros de cada clase de antibióticos no han causado resistencia, mientras que otros sí.
La cefalosporina de tercera generación ceftriaxona es un ejemplo de un antibiótico con bajo potencial de resistencia que, incluso después de décadas de ser usada en gran volumen, muestra muy poca resistencia clínicamente significativa u. Otra cefalosporina de tercera generación, la ceftriaxona, es el único antibiótico con alto potencial de resistencia que se asocia con P. aeruginosaresistente.
Entre las fluoroquinolonas, la ciprofloxacina es la quinolona con alto potencial de resistencia, mientras que la levofloxacina y la moxifloxacina son antibióticos con bajo potencial de resistencia.
El mensaje para los médicos es claro: para cualquier infección, la forma de prevenir la resistencia es usar preferentemente los antibióticos con bajo potencial de resistencia.Casi siempre, dentro la misma clase de antibióticos hay otras alternativas que proporcionan una actividad similar o mejor contra el patógeno que los antibióticos con alto potencial de resistencia.
Aunque las consideraciones farmacodinámicas pueden minimizar el potencial de resistencia de los antibióticos con alto potencial de resistencia, el mejor enfoque es preferir los antibióticos con bajo potencial de resistencia.
Puede desarrollarse resistencia si el contexto clínico es incorrecto, por ejemplo, al tratar un absceso incluso con un antibiótico de bajo potencial de resistencia, ya que dentro del absceso, las concentraciones que se logran son bajas y pueden predisponer a la resistencia.
Los patógenos que son activos en forma intermitente, que viven en un biofilm cubriendo la superficie de un cuerpo extraño, crean un ambiente ideal para la aparición de resistencia. En situaciones donde hay un flujo sanguíneo deteriorado o problemas de mala penetración tisular, puede ocurrir resistencia con cualquier antibiótico, pero ciertamente es más frecuente con los antibióticos con alto potencial de resistencia.
Un esfuerzo adicional para limitar la resistencia es aplicar el tratamiento durante el menor lapso posible que la infección permita. Los cursos más largos no son más eficaces y pueden predisponer a la resistencia.
| Potencial de resistencia inherente de antibióticos seleccionados |
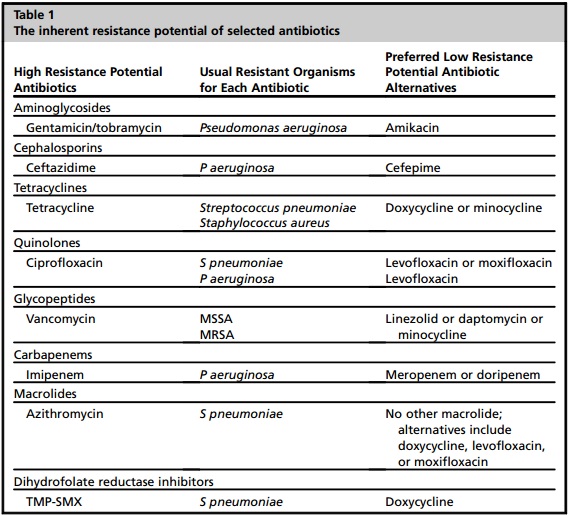
MRSA, S. aureus meticilina-resistente; MSSA, S. aureus meticilina sensible ;TMP-SMX, trimetoprima-sulfametoxazol. Datos de Cunha BA. Effective antibiotic-resistance control strategies. Lancet. 2001;357(9265):1307–8; and Cunha BA, editor. Antibiotic essentials. 12th edition. Sudbury (MA): Jones & Bartlett Learning; 2013.
> Dosificación de antibióticos para optimizar la eficacia y minimizar la resistencia
Se deben considerar los aspectos farmacodinámicos del medicamento, lo que está relacionado con su concentración y distribución en el suero y los fluidos corporales, en función del tiempo. Las concentraciones séricas están relacionadas con las concentraciones séricas máximas, la vida media en el suero, los hallazgos proteicos y la función renal y hepática.
Las características de penetración tisular de los antibióticos están determinadas por parámetros farmacocinéticos, como la concentración sérica pico, la unión a las proteínas y el volumen de distribución. La mejoría clínica debe volver a evaluarse en el día 3. Si hay mejoría clínica, la terapia se completa con el mismo medicamento que se estaba utilizando.
En el tratamiento de la infección, la farmacodinamia está referida a la destrucción bacteriana provocada por los antibióticos y se describe ya sea demostrando la destrucción dependiente de la concentración, la destrucción dependiente del tiempo o, la combinación de ambas.
La cinética de la destrucción bacteriana dependiente de la concentración se refiere a que la destrucción bacteriana aumenta cuando las concentraciones de antibióticos superan la CIM, y se expresa como la concentración de antibiótico (Cmax) en el suero, en relación con una determinada CIM.
Los antibióticos que muestran concentraciones dependientes de la concentración, como los aminoglucósidos, la daptomicina y el metronidazol, suelen mostrar un efecto pos antibiótico, lo que indica que el rebrote del patógeno se retrasa varias horas después de haber desaparecido los niveles adecuados de antibióticos en la sangre.
Los antibióticos que muestran una cinética de destrucción dependencia del tiempo son aquellos en los que un aumento de los niveles séricos no provoca un aumento de la muerte bacteriana sino hasta haber superado 4 a 5 veces la CIM del organismo, y se expresa como la concentración del fármaco dependiente del tiempo que permanece por encima de la CIM durante el período de dosificación (T>CIM), como muestran los antibióticos ß-lactámicos, carbapenems o macrólidos.
Otros antibióticos (por ej., fluoroquinolonas) expresan una cinética de destrucción mejor que se describe por el parámetro farmacodinámico conocido como área bajo la curva del tiempo de concentración durante un período de 24 horas, es decir, el área bajo la curva, AUC0-24:CIM.
Es interesante que algunos antibióticos muestran ambas cinéticas de destrucción, la dependiente del tiempo y la dependiente de la concentración, por ejemplo, la doxiciclina y la vancomicina.
La cinética de la destrucción dependiente del tiempo describe la farmacodinamia de la vancomicina en presencia de cocos grampositivos, con una CIM <1 mg/ml; sin embargo, con una CIM >1 mg/ml, la vancomicina muestra una cinética de destrucción dependiente de la concentración. Incluso entre los antibióticos que demuestran una función de destrucción dependiente del tiempo no hay ningún inconveniente en usar dosis elevadas de tratamiento antimicrobiano.
En general, los antibióticos bacteriostáticos muestran una cinética de destrucción dependiente del tiempo, mientras que los antibióticos bactericidas muestran una cinética de destrucción dependiente de la concentración, pero algunos antibióticos exhiben ambos tipos de cinética destructiva.
La doxiciclina, por ejemplo, que muestra una cinética de destrucción dependiente del tiempo, cuando se usa en concentraciones elevadas es bactericida contra algunos patógenos, y por lo tanto presenta una cinética de destrucción dependiente de la concentración.
Las penicilinas, monobactams y carbapenems muestran cinéticas de destrucción dependientes del tiempo, pero son bactericidas.
| Quinolonas |
Las quinolonas muestran principalmente una cinética de destrucción dependiente de la concentración, pero también muestran algunas características cinéticas de la destrucción dependiente del tiempo.
Se ha demostrado que la relación AUC0-24:CIM se correlacionan con los resultados clínicos, es decir, una proporción AUC0-24:CIM >125 suele considerarse predictiva de eficacia en las infecciones gramnegativas. Sin embargo, una proporción AUC0-24:CIM más elevada, >250, puede ser óptima y reducir la resistencia.
Teniendo en cuenta estos factores, se debe optimizar la dosis de quinolona, con el fin de utilizar la dosis más elevada posible, evitando la toxicidad, lo que optimiza no solo la relación Cmax:CIM sino también la relación AUC0-24:CIM, pues puede minimizar el potencial de emergencia de mutantes resistentes.
Las descripciones farmacodinámicas de la vancomicina difieren según la CIM de los estafilococos. Con CIM >1, la vancomicina muestra una cinética de destrucción dependiente de la concentración, mientras que con una CIM <1, su cinética de destrucción es dependiente del tiempo.
Por otra parte, el uso de vancomicina puede aumentar el espesor de la pared celular del estafilocócica, lo que disminuye la permeabilidad de la vancomicina en el organismo, así como la de otros antibióticos. Esta resistencia mediada por la permeabilidad se manifiesta ya sea por un aumento de las CIM de la vancomicina, como las de otros organismos grampositivos.
Los pacientes con osteomielitis pueden tratarse durante meses sin efectos adversos y con resultados óptimos, con dosis elevadas de vancomicina. Debido a que las formulaciones de vancomicina actuales son esencialmente no nefrotóxicas, se prefiere usar dosis elevadas de vancomicina.
La administración de vancomicina en dosis elevadas, por e., 60 mg/kg (intravenosa [IV]) c/24 horas o, 2 g (IV) c/12 horas, es una estrategia razonable en los adultos con función renal normal, porque puede optimizar la eficacia y minimizar la resistencia. Al igual que con otros antibióticos, las dosis bajas de vancomicina se han asociado al desarrollo de resistencia.
> ß-lactámicos
Las ß-lactámicos muestran una cinética de destrucción dependiente del tiempo; la muerte bacteriana óptima ocurre cuando las concentraciones de antibióticos son aproximadamente 5 veces la CIM del organismo.
Por encima de 5 veces la CIM del organismo no hay muerte bacteriana adicional. Mientras las concentraciones séricas permanecen por encima de la CMI, la inhibición de los organismos sensibles se logra durante más del 75% del intervalo de dosificación.
Los ß-lactámicos son bactericidas y, aunque tienen un efecto pos antibiótico mínimo sobre las bacterias grampositivas, ese efecto no se aprecia sobre los organismos gramnegativos.
Debido a que los ß- lactámicos tienen una cinética de destrucción dependiente del tiempo, algunos investigadores han recomendado una dosificación más frecuente o una infusión continua, con el fin de mantener una concentración efectiva durante toda la dosificación.
En la mayoría de los hospitales, la estrategia preferida es aumentar la duración de la dosis o acortar el intervalo de dosificación. Una dosis más elevada también resulta en concentraciones séricas más elevadas durante la mayor parte del período de dosificación.
Por lo tanto, una dosis elevada y una duración de dosificación prolongada (2–3 horas) es una forma óptima de administrar los antibióticos ß-lactámicos, particularmente en el entorno de cuidados intensivos, para maximizar la efectividad y minimizar el potencial de resistencia.
En cuanto a la penetración tisular, son preferibles los niveles séricos más elevados, con antibióticos cuya cinética depende del tiempo, por ejemplo, los ß-lactámicos. Las dosis más elevadas significan mayor nivel en el tejido, porque la penetración tisular es un porcentaje de la concentración sérica máxima; con los antibióticos dependientes del tiempo y de la concentración, cuanto mayor es la concentración sérica, más elevados son los niveles en los tejidos diana.
> Carbapenems
Los carbapenems se parecen estructuralmente a los ß-lactámicos y tienen características farmacodinámicas similares a otros ß-lactámicos, pero difieren en su potencial alérgico. Las concentraciones séricas de carbapenem deben superar 5 veces la CIM y mantenerse durante al menos el 40% del intervalo de dosificación, en contraste con las penicilinas (~60%) y las cefalosporinas (~75%).
El potencial de resistencia de los carbapenems parece que no solo está relacionado con los parámetros farmacodinámicos, sino también con el potencial de resistencia inherente del antibiótico; por ejemplo, el imipenem tiene un elevado potencial de resistencia mientras que el meropenem y el doripenem tienen un potencial de resistencia bajo. Con estos antibióticos, la mejor estrategia también parece ser utilizarlos en dosis elevadas con el fin de optimizar la efectividad, y no solo en tener en cuenta los parámetros farmacodinámicos.
> Daptomicina
La daptomicina, que es bactericida contra los organismos grampositivos, muestra una cinética de destrucción dependiente de la concentración, y tiene un efecto pos antibiótico prolongado (>6 horas). Al igual que con otros antibióticos, la daptomicina muestra características farmacodinámicas duales, es decir, Cmax/CIM y AUC0-24:CIM.
Los regímenes de dosificación recomendados para la daptomicina están relacionados con el sitio de la infección, es decir, 4 mg/kg (IV) c/24 horas para las infecciones cutáneas y tejidos blandos o, 6 mg/kg (IV) c/24 horas para las bacteriemias. Para los organismos relativamente resistentes, se han utilizado exitosamente dosis elevadas de daptomicina, 10 a 12 mg/kg (IV) c/24 horas.
Al igual que con otros antibióticos, las dosis bajas predisponen a la resistencia. La daptomicina es casi la mitad de activa contra los estreptococos del grupo D que contra los estafilococos. No es de extrañar que la dosis habitual pueda dar lugar tanto a enterococos resistentes como sensibles a la vancomicina.
> Linezolida
La linezolida muestra una cinética de destrucción dependiente del tiempo y es bacteriostática contra los estafilococos y enterococos, pero es bactericida contra los estreptococos no pertenecientes al grupo D. Se ha utilizado con éxito en el tratamiento de la endocarditis bacteriana aguda, para la cual, teóricamente se prefieren los antibióticos bactericidas.
En el caso de la endocarditis bacteriana aguda por Staphylococcus aureus, el resultado es comparable al de la terapia con antibióticos antiestafilocócicos bactericidas. El tratamiento prolongado con linezolida ha demostrado estar asociado con resistencia, como ha sucedido con la daptomicina.
> Tigeciclina
Debido a que la tigeciclina es un derivado de la tetraciclina, se considera que muestra una cinética de destrucción dependiente del tiempo, pero su régimen de dosificación óptimo aún no se ha determinado. Para lograr concentraciones séricas terapéuticas, este antibiótico requiere una dosis de carga, pues posee un elevado volumen de distribución (8 l/kg).
Debido a que generalmente se tolera bien, puede ser que para los organismos gramnegativos relativamente resistentes, se necesite una dosis de carga mayor a la habitual (100 mg), por ejemplo, 200 a 400 mg. La dosis de mantenimiento de la tigeciclina que se recomienda es 50 mg (IV) c/12 horas.
Debido a que su vida media es tan larga (42 horas), no tiene sentido administrarla c/12 horas. Desde el punto de vista farmacocinético, después de la carga inicial, la dosis de mantenimiento (mitad de la dosis de carga) debe ser administrada c/24 horas y no en dosis divididas.
La preocupación por los posibles fracasos terapéuticos de la tigeciclina que aparece en la literatura se refiere al tratamiento de organismos resistentes a la tigeciclina de forma innata, por ejemplo, P. aeruginosa, o a la subdosificación.
| Resumen Los principales conceptos expresados hasta aquí son:
|
Resumen y comentario objetivo: Dra: Marta Papponetti