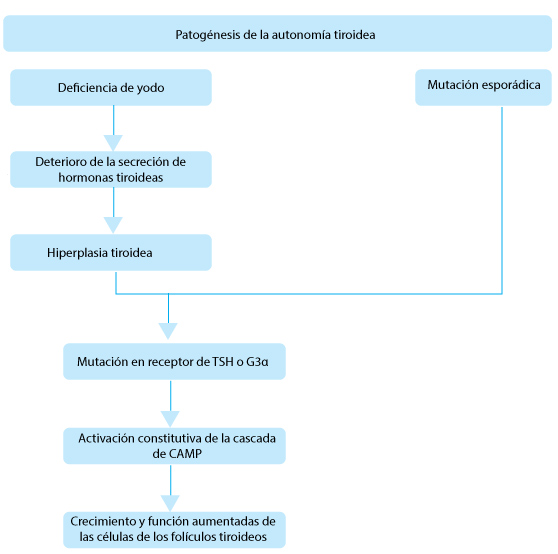
Obesidad: ¿hacia dónde va el mundo?
Análisis sistemático de sobrepeso y obesidad en personas de 195 países en el transcurso de 25 añosAutor: Ashkan Afshin, MD, Sc.D., Mohammad H. Forouzanfar M.D y colaboradores N Engl J Med 2017; 377:13-27. July 6, 2017
Introducción
La prevalencia de sobrepeso y obesidad está aumentando en todo el mundo.1 Estudios epidemiológicos identificaron el alto índice de masa corporal (IMC, el peso en kilogramos dividido por el cuadrado de la altura en metros) como un factor de riesgo de un conjunto en expansión de enfermedades crónicas, incluyendo la enfermedad cardiovascular,2,3 la diabetes mellitus, la enfermedad renal crónica,2 muchos tipos de cánceres,4 y una serie de trastornos musculoesqueléticos.5,6
Como la comunidad mundial de salud trabaja para desarrollar tratamientos y políticas de prevención para tratar la obesidad, se necesita información oportuna sobre los niveles de IMC elevado y los efectos sobre la salud a nivel de la población.
En los últimos años, se incrementaron los esfuerzos para evaluar las tendencias del IMC dentro y fuera de los países.7,8 Otros estudios cuantificaron los efectos potenciales del IMC alto en una variedad de resultados en salud.2,4 Estos esfuerzos, si bien fueron útiles, no consideraron la relación del alto IMC con el desarrollo socioeconómico más amplio; también excluyeron muchas fuentes de datos, centrados exclusivamente en adultos, capturaron inadecuadamente la distribución sesgada del IMC, no captaron evidencias emergentes sobre resultados adicionales, y no evaluaron el efecto de la transición epidemiológica y demográfica sobre la carga de la enfermedad. El IMC asociado con el menor riesgo de muerte también ha sido cuestionado.9,10
Para abordar estas lagunas en el conocimiento, los autores evaluaron las tendencias en la prevalencia de sobrepeso y obesidad, así como los patrones de muertes y de años de vida ajustados por discapacidad al IMC elevado, según edad y sexo, en 195 países. Este análisis reemplaza a todos los resultados previos del estudio sobre la Carga Global de Enfermedad con respecto al alto IMC al reanalizar todos los datos desde 1990 a 2015 utilizando métodos y definiciones consistentes.
► MÉTODOS
♦ Prevalencia y carga de enfermedad del sobrepeso y la obesidad
Los autores estimaron sistemáticamente la prevalencia de sobrepeso y obesidad entre los niños (<20 años de edad) y los adultos entre 1980 y 2015. Utilizando el enfoque comparativo de evaluación del riesgo del estudio sobre la Carga Global de Enfermedad, también cuantificaron la carga de enfermedad relacionada con el alto IMC durante el período comprendido entre 1990 y 2015.
La carga de la enfermedad se evaluó por años de vida ajustados por discapacidad, una métrica compuesta calculada como la suma de años vividos con discapacidad y años de vida perdidos debido al alto IMC. En este análisis, los autores utilizaron la distribución del IMC según edad, sexo, país y año; el tamaño del efecto del cambio en el IMC en los puntos finales de la enfermedad; el IMC asociado con el menor riesgo de muerte por todas las causas; y la mortalidad y morbilidad específica por enfermedad de acuerdo a edad, sexo, país y año.
♦ Distribución global del IMC
Los autores realizaron búsquedas sistemáticas en Medline para estudios que representan a nivel nacional o subnacional estimaciones de IMC, sobrepeso u obesidad entre niños o adultos. Los autores incluyeron estudios si utilizaron puntos de corte estándar del IMC para definir el sobrepeso (IMC, 25 a 29) y la obesidad (IMC, ≥ 30) entre adultos o las normas del Grupo Internacional de Trabajo sobre Obesidad para definir el sobrepeso y la obesidad entre los niños.
Además, se realizaron búsquedas en el Global Health Data Exchange (http://ghdx.healthdata.org) para programas de encuestas multinacionales, encuestas nacionales y estudios longitudinales que proporcionan datos auto reportados o mediciones sobre altura y peso en niños o adultos.
Con respecto a los datos relativos a los adultos, los autores identificaron 1276 fuentes de datos únicas (855 medidas y 421 auto reportadas) de 176 países que proporcionan datos sobre IMC, 1333 fuentes (802 medidas y 531 auto reportadas) de 176 países que proporcionan datos sobre sobrepeso, y 1514 fuentes (713 medidas y 801 auto reportadas) de 174 países que proporcionan datos sobre obesidad.
Con respecto a los datos de los niños, los autores identificaron 1211 fuentes de datos únicos (800 medidas y 411 auto reportadas) de 173 países que proporcionan datos sobre el IMC, y 1236 fuentes (832 medidas y 404 auto reportadas) de 174 países que proporcionan datos sobre sobrepeso, y 1437 fuentes (928 medidas y 509 auto reportadas) de 175 países que proporcionan datos sobre obesidad.
Usando modelos de regresión lineal de efectos mixtos, los autores estimaron y corrigieron por separado el auto-reporte entre hombres y mujeres de acuerdo con la región geográfica y el grupo de edad. Los autores caracterizaron la edad y los patrones de sexo por IMC, sobrepeso, y obesidad y aplicaron estos patrones para dividir datos agregados en grupos de 5 años de acuerdo al sexo.
Los autores utilizaron la regresión del proceso gaussiano espaciotemporal para estimar la prevalencia media de obesidad y sobrepeso.11 Para mejorar sus estimaciones en los datos esparcidos de los países, los autores probaron una amplia gama de covariables con relaciones plausibles con sobrepeso y obesidad. Los autores seleccionaron tres covariables a nivel país con mejores ajustes y coeficientes en la dirección esperada, como se utilizó en otros estudios.8
Estos factores incluyeron la ingesta de energía distribuida en 10 años (es decir, la energía ponderada en función del tiempo del promedio de la ingesta diaria de energía) per cápita, el latitud absoluta del país, y la proporción de las personas que viven en zonas urbanas.
Para estimar la media de IMC, los autores primero utilizaron regresión lineal de efectos mixtos para caracterizar la relación entre el IMC, el sobrepeso y la obesidad en las fuentes que contienen información sobre las tres medidas. Los autores aplicaron los coeficientes de esta regresión a la prevalencia de sobrepeso y de obesidad generada mediante el proceso de regresión espacio-temporal Gaussiano para estimar el IMC medio para cada país, según la edad, el sexo y el año.
Entre los 195 países y territorios que se incluyen en el presente estudio, los datos sobre sobrepeso, obesidad, o IMC no estaban disponibles para sólo 8: Antigua y Barbuda, Bermuda, Brunei, Islas Marianas del Norte, San Vicente y las Granadinas, las Bahamas, Turkmenistán y Venezuela. Las estimaciones en estos países se construyeron puramente de las covariables utilizadas en la estimación del modelo lineal y de los residuos ponderados y suavizados de los datos de los países vecinos.
Para identificar la distribución apropiada del IMC a nivel poblacional, los autores examinaron cómo varias distribuciones (es decir, log-normal, gamma, Gaussiano inverso y beta) se aproximaron a la distribución de los datos reales de las encuestas nacionales de seis países; el mejor ajuste fue proporcionado por la distribución beta.12 Se caracterizó la forma de la distribución beta basándose en el IMC medio y en la prevalencia de sobrepeso y obesidad en cada país según edad, sexo y año. Los detalles de este enfoque se describieron anteriormente.12
♦ Efecto del alto IMC sobre los resultados en salud
Los autores utilizaron los criterios de Bradford Hill para la causalidad y los criterios de clasificación de las pruebas del Fondo Mundial de Investigación de Cáncer para evaluar sistemáticamente la evidencia epidemiológica que apoya la relación causal entre el alto IMC y varios puntos finales de enfermedades entre adultos de 25 años o mayores.13
Encontraron evidencia convincente o probable con una asociación con 20 resultados de salud. Para cada resultado, los autores obtuvieron el riesgo relativo de un metaanálisis dosis-respuesta de estudios prospectivos observacionales.
Utilizando análisis agrupados de estudios de cohorte, estimaron el riesgo relativo asociado con un cambio de cinco unidades de IMC en grupos de 5 años de edad para cardiopatía isquémica, accidente cerebrovascular isquémico, accidente cerebrovascular hemorrágico, enfermedad cardíaca hipertensiva y diabetes mellitus.
Para cáncer de mama, se calculó el riesgo relativo para mujeres premenopáusicas y posmenopáusicas según la región (según se especifica en el estudio sobre Carga Global de Enfermedad) debido a la evidencia de que el sobrepeso y la obesidad tienen un efecto protector contra el cáncer de mama en las mujeres premenopáusicas en todos los países exceptuando las regiones de Asia y del Pacífico,14,15 mientras que se observó una asociación positiva entre el alto IMC y la incidencia de cáncer de mama posmenopáusico en todo el mundo.15
♦ El IMC de menor riesgo
Se utilizó el análisis conjunto más reciente de estudios observacionales para determinar el IMC asociado con el menor riesgo general de muerte.9 Para abordar las limitaciones de los estudios previos sobre este tema, que incluyeron confundidores residuales entre los fumadores y la causalidad inversa debido a enfermedades crónicas preexistentes,10 el análisis se restringió a los nunca fumadores sin enfermedades crónicas identificadas que sobrevivieron 5 años después del reclutamiento. El menor riesgo general de muerte se observó para un IMC de 20 a 25.
♦ Análisis estadístico
Para cuantificar la carga de enfermedad relacionada con el IMC para cada punto final de la enfermedad, los autores calcularon la fracción atribuible a la población según país, edad, sexo y año.16 Calcularon el número de muertes y los años de vida ajustados por discapacidad relacionados con el alto IMC para cada país, de acuerdo con la edad, sexo, año y causa, multiplicando la fracción atribuible a la población por el número total de muertes o de años de vida ajustados por discapacidad, según el estudio de la Carga Global de Enfermedad para ese país, edad, sexo, año y causa.
Calcularon la carga total de enfermedad relacionada con el alto IMC como la suma de las cargas específicas de enfermedad. Para comprender en que parte de la distribución del IMC ocurre la mayor carga de enfermedad, los autores estimaron las fracciones atribuibles a la población para tres rangos de IMC (20 a 24, 25 a 29, y ≥ 30) y para cinco grupos de enfermedad final (enfermedad cardiovascular, diabetes mellitus, enfermedad renal crónica, cánceres y trastornos musculoesqueléticos).
Utilizando los métodos desarrollados por Das Gupta,17 los autores rompieron el cambio en el número de muertes y el número de casos de años de vida ajustados por discapacidad que se atribuyeron al alto IMC entre el crecimiento poblacional, la estructura de edad de la población, el riesgo de la exposición al IMC elevado y las tasas de riesgo eliminado de mortalidad y años de vida ajustados por discapacidad. (Las tasas de riesgo eliminado son la carga de enfermedad en ausencia del factor de riesgo - por ejemplo, las tasas de muerte por enfermedad cardiovascular que podrían observarse si todos estuvieran en el IMC de menor riesgo).
Se calcularon intervalos de incertidumbre del 95% para todos los resultados utilizando simulaciones Monte Carlo, acordando 1000 sorteos de cada cantidad de interés para propagar incertidumbre en las estimaciones finales. El modelo incluía la incertidumbre de las encuestas de exámenes, los riesgos relativos para cada resultado del análisis o del metaanálisis de las cohortes, el IMC de menor riesgo, y el número de muertes y de años de vida ajustados por discapacidad estimados para cada país, edad, sexo, año y resultado del estudio de Carga Global de Enfermedad 2015.
De acuerdo a los métodos en ese estudio, se utilizó un índice sociodemográfico (ISD) - una medida resumida de los ingresos per cápita distribuidos con retraso, logros educacionales promedio entre las personas mayores de 15 años, y la tasa total de fertilidad - para posicionar a los países en el continuo del desarrollo. Entonces los autores generaron quintiles de ISD para categorizar a los países como en un nivel de desarrollo bajo, bajo-medio, medio, alto-medio y alto.13
► RESULTADOS
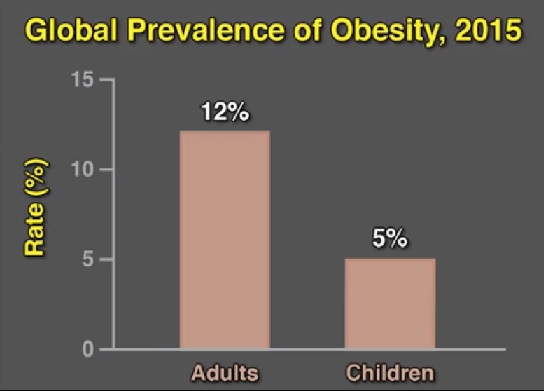
En 2015, 107,7 millones de niños y 603,7 millones de adultos eran obesos en todo el mundo
♦ Prevalencia de obesidad (1980-2015)
• Nivel global
En 2015, los autores estimaron que 107,7 millones de niños (intervalo de incertidumbre, 101,1 a 115,1) y 603,7 millones de adultos (intervalo de incertidumbre, 592,9 a 615,6) eran obesos en todo el mundo. La prevalencia general de obesidad era del 5% entre los niños y del 12% entre los adultos.
Entre los adultos, la prevalencia de obesidad fue generalmente más alta entre las mujeres que entre los hombres en todos los grupos de edad. El pico en la prevalencia de obesidad se observó entre las edades de 60 y 64 años entre las mujeres y entre los 50 y los 54 años entre los hombres.
Las tasas de aumento de obesidad entre 1980 y 2015 no difirieron significativamente entre las mujeres y los hombres en cualquier grupo de edad; para ambos grupos, las tasas de aumento fueron más altas en la edad adulta temprana.
Entre los niños, la prevalencia de obesidad en 2015 disminuyó con la edad hasta los 14 años y luego aumentó; no se observaron diferencias entre los sexos en la prevalencia de obesidad antes de la edad de 20 años. Entre 1980 y 2015, las tasas de incremento global de obesidad infantil fueron iguales para niños y niñas en todas las edades.
• Nivel ISD
En 2015, en todos los niveles de ISD y para todos los grupos de edad, la prevalencia de obesidad fue generalmente mayor para las mujeres que para los hombres, con la prevalencia más alta entre las mujeres de 60 a 64 años viviendo en países con un alto ISD. En general, la prevalencia de obesidad tanto entre hombres como entre mujeres aumentó con el aumento del ISD en todos los grupos de edad.
Una excepción fue la prevalencia de obesidad entre mujeres viviendo en países con un ISD bajo, ya que después de los 55 años, la prevalencia fue más alta que la observada para las mujeres en los países con un ISD bajo-medio.
Durante el período de 1980 a 2015, el aumento relativo más rápido de la prevalencia de obesidad ocurrió entre hombres de 25 y 29 años que vivían en países con un ISD bajo-medio, del 1,1% (intervalo de incertidumbre, 0,9 a 1,5) en 1980 a 3,8% (intervalo de incertidumbre del 95%, 3,1 a 4,8) en 2015. Durante el mismo período, la prevalencia de obesidad aumentó en un factor de 1,7 entre hombres y mujeres en los países con un ISD bajo-medio.
Entre los niños, la prevalencia de obesidad fue mayor en los países con mayores niveles de ISD. En la mayoría de los niveles de ISD, la prevalencia de obesidad fue menor entre los niños y las niñas entre las edades de 10 y 14 años. En los países con niveles de ISD alto y alto-medio, la prevalencia fue generalmente mayor entre los niños que entre las niñas, aunque esta diferencia se invirtió al comienzo de la adolescencia tardía.
Entre 1980 y 2015, hubo un aumento relativo significativo del 20% (intervalo de incertidumbre del 95%, de 5,5 a 35,3) en la prevalencia de obesidad en los países con un ISD bajo entre niñas y niños. Durante ese período, las mayores tasas de aumento se observaron en países con un ISD medio entre las niñas y los niños.
• Nivel nacional
La prevalencia de obesidad entre los niños y los adultos se duplicó en 73 países desde 1980 y mostró un aumento continuo en la mayoría de los otros países. Aunque la prevalencia de la obesidad en la infancia fue menor que la prevalencia de la obesidad en la adultez, la tasa de aumento de la obesidad infantil en muchos países fue mayor que la tasa de aumento de la obesidad en los adultos.
Un conjunto completo de datos de todos los resultados para cada país según edad, sexo, y año está disponible en el sitio web de los Datos de Salud Global (http://ghdx.healthdata.org/), y se provee una visualización interactiva de datos de la prevalencia de sobrepeso y obesidad en línea (https://vizhub.healthdata.org/obesity/). Los autores remarcan los hallazgos relacionados con la obesidad en los países más poblados.
En 2015, entre los 20 países más poblados, el nivel más alto de obesidad en adultos estandarizado por edad se observó en Egipto (35,3%; intervalo de incertidumbre 95%, 33,6 a 37,1), y el nivel más alto de obesidad infantil estandarizado por edad se observó en los Estados Unidos (12,7%; intervalo de incertidumbre del 95%, 12,2 a 13,2).
La prevalencia fue menor entre los adultos en Vietnam (1,6%; intervalo de incertidumbre del 95%, 1,4 a 2) y entre los niños en Bangladesh (1,2%; intervalo de incertidumbre del 95%, 0,9 a 1,7). Entre 1980 y 2015, la prevalencia estandarizada por edad de la obesidad aumentó por un factor de 2 o más en 13 de los 20 países; sólo la República Democrática del Congo no tenía incremento. En 2015, China e India tenían los mayores números de niños obesos, mientras que Estados Unidos y China tenían los números más altos de adultos obesos.
♦ Carga de enfermedad relacionada con el alto IMC (1990-2015)
• Nivel global
La enfermedad cardiovascular fue la causa principal de muerte y de años de vida ajustados por discapacidad relacionados con un alto IMC y representaron 2,7 millones de muertes
En 2015, el alto IMC contribuyó a 4 millones de muertes (intervalo de incertidumbre del 95%, 2,7 a 5,3), lo que representó el 7,1% (intervalo de incertidumbre del 95%, 4,9 a 9,6) de las muertes por cualquier causa; también contribuyó a 120 millones de años de vida ajustados por discapacidad (intervalo de incertidumbre del 95%, 84 a 158), lo que representó el 4,9% (intervalo de incertidumbre del 95%, 3,5 a 6,4) de los años de vida ajustados por discapacidad de cualquier causa entre los adultos en todo el mundo. Un total del 39% de las muertes y del 37% de los años de vida ajustados por discapacidad estaban relacionados con el alto IMC en personas con un IMC inferior a 30.
La enfermedad cardiovascular fue la causa principal de muerte y de años de vida ajustados por discapacidad relacionados con un alto IMC y representaron 2,7 millones de muertes (intervalo de incertidumbre del 95%, 1,8 a 3,7) y 66,3 millones de años de vida ajustados por discapacidad (intervalo de incertidumbre del 95%, 45,3 a 88,5). A nivel mundial, el 41% de las muertes relacionadas con el IMC y el 34% de los años de vida ajustados por discapacidad del IMC se debieron a enfermedad cardiovascular entre personas obesas.
La diabetes fue la segunda causa principal de muerte relacionada con el IMC en 2015 y contribuyó a 0,6 millones de muertes (intervalo de incertidumbre del 95%, 0,4 a 0,7) y a 30,4 millones de años de vida ajustados por discapacidad (intervalo de incertidumbre del 95% 21,5 a 39,9); entre todas las muertes relacionadas con el IMC que se debían a la diabetes, el 9,5% se produjo con un IMC de 30 o más y el 4,5% ocurrieron con un IMC menor de 30.
La enfermedad renal crónica fue la segunda causa principal de años de vida ajustados por discapacidad relacionados con el IMC en 2015; el 18% de los años de vida ajustados por discapacidad ocurrieron con un IMC de 30 o más y el 7,2% con un IMC inferior a 30.
La enfermedad renal crónica y los cánceres representaron cada uno menos del 10% de todas las muertes relacionadas con el IMC en 2015, mientras que los cánceres, la diabetes y los trastornos musculoesqueléticos contribuyeron cada uno menos del 10% de los años de vida ajustados por discapacidad relacionados con el IMC.
El alto IMC también representó 28,6 millones de años vividos con discapacidad (intervalo de incertidumbre del 95%, 17,8 a 41,4), lo que representaron el 3,6% (intervalo de incertidumbre del 95%, 2,7 a 4,6) de años vividos con discapacidad debido a cualquier causa a nivel mundial. La diabetes fue la causa principal de los años vividos con discapacidad relacionados con el IMC (17,1 millones, intervalo de incertidumbre del 95%, 10,6 a 24,4), seguido de los trastornos musculoesqueléticos (5,7 millones, intervalo de incertidumbre del 95%, 3,4 al 8,8) y enfermedad cardiovascular (3,3 millones; intervalo de incertidumbre del 95%, 2 a 4,9).
Desde 1990 hasta 2015, hubo un aumento relativo del 28,3% en la tasa mundial de mortalidad relacionada con un IMC elevado, de 41,9 muertes por 100.000 habitantes en 1990 a 53,7 muertes por 100.000 habitantes en 2015. Sin embargo, no hubo un cambio significativo en las tasas de muerte estandarizadas por edad durante este período, con una tasa de 64 (intervalo de incertidumbre 95%, 41,7 a 89,7) por 100.000 habitantes en 1990 y 60,2 (intervalo de incertidumbre del 95% 41,4 a 81,5) por 100.000 habitantes en 2015.
Del mismo modo, durante el mismo período, hubo un aumento relativo del 35,8% en la tasa de años de vida ajustados por discapacidad relacionado con el IMC, desde 1200 por 100.000 habitantes a 1630 por 100.000 habitantes, considerando que no hubo cambios significativos en las tasas estandarizadas por edad.
Globalmente, los incrementos en las muertes relacionadas con el IMC y los años de vida ajustados por discapacidad debido al crecimiento de la población, el envejecimiento de la población, y el aumento de la exposición al riesgo fueron parcialmente compensados por las reducciones en las tasas subyacentes de muerte y por los años de vida ajustados por discapacidad.
De los puntos finales de la enfermedad que se consideraron en este estudio, la disminución de las tasas de riesgo eliminado de muerte por enfermedades cardiovasculares fue lo que más contribuyó a este patrón. Los cambios debidos al riesgo de exposición al IMC elevado y el envejecimiento de la población fueron aproximadamente iguales en términos de su contribución al porcentaje de cambios en las muertes y años de vida ajustados por discapacidad relacionados con el IMC en todo el mundo desde 1990 hasta 2015.

Porcentaje de cambios y factores de cambio en los años de vida y defunciones ajustados por discapacidad a nivel mundial, según SDI
• Nivel ISD
En 2015, las tasas estandarizadas por edad de muertes y años de vida ajustados por discapacidad relacionados con el alto IMC fueron mayores en los países con niveles de ISD altos-medianos, con una tasa de muerte de 68,1 (intervalo de incertidumbre 95%, 47,1 a 91,6) por 100.000 habitantes y una tasa de años de vida ajustados por discapacidad de 1890 (intervalo de incertidumbre de 95%, 1330 a 2460) por 100.000 habitantes.
Las tasas de ambas medidas fueron menores en países con altos niveles de ISD, con una tasa de muerte de 52,6 (intervalo de incertidumbre 95%, 38,7 a 67,9) por 100.000 habitantes y una tasa de años de vida ajustados por discapacidad de 1530 (intervalo de incertidumbre del 95%, 1160 a 1920) por cada 100.000 habitantes. La tasa de muertes relacionadas con el IMC aumentó entre 1990 y 2015 en todos los niveles de ISD, con la tasa más alta observada de 90,6 (95% de intervalo de incertidumbre 65,8 a 117,3) por 100.000 habitantes en países con un alto ISD en 2005.
Las tasas de muerte estandarizadas por edad en los países con ISD alto o alto-medio disminuyó entre 1990 y 2015; en los quintiles más bajos de ISD, las tasas de muerte relacionadas con el IMC estandarizadas por edad aumentaron. Con el aumento de los niveles de ISD, la contribución de la mortalidad por riesgo eliminado al cambio porcentual en las muertes relacionadas con el IMC aumentó, mientras que la contribución del crecimiento de la población al porcentaje de las muertes relacionadas con el IMC disminuyó. La contribución de la exposición al riesgo al porcentaje de cambio en las muertes relacionadas con el IMC también estuvo inversamente relacionada con el ISD.
Los patrones en el desglose de las fuentes de cambio en los años de vida ajustados por discapacidad fueron paralelos a los observados para la mortalidad. En un desglose específico por enfermedad, el riesgo eliminado de mortalidad y los años de vida ajustado por discapacidad mostró una tendencia decreciente para las causas en todos los niveles de ISD. Las mayores disminuciones en las tasas de riesgo eliminado de muerte y de años de vida ajustados por discapacidad se observaron para la enfermedad cardiovascular, mientras que los cánceres y los trastornos musculoesqueléticos mostraron la menor disminución.
• Nivel nacional
En 2015, entre los 20 países más poblados, las tasas más altas de muerte relacionadas con el IMC y los años de vida ajustados por discapacidad se observaron en Rusia, y las tasas más bajas se observaron en la República Democrática del Congo.
Entre 1990 y 2015, el mayor porcentaje de cambios en las muertes estandarizadas por edad relacionadas con el IMC y años de vida ajustados por discapacidad ocurrió en Bangladesh, con aumentos relativos del 133,6% (intervalo de incertidumbre del 95%, 66,3 a 265,7) y del 139,4% (intervalo de incertidumbre del 95%, 77,2 a 273), respectivamente. Durante el mismo período, Turquía tuvo la mayor disminución significativa en la carga estandarizada por edad relacionada con el IMC, con una disminución del 43,7% (intervalo de incertidumbre del 95%, 36,9 a 49,8) en las muertes y del 37,2% (intervalo de incertidumbre del 95%, 29,9 a 44) en los años de vida ajustados por discapacidad.
► DISCUSIÓN
En la evaluación sistemática de los autores sobre los efectos del IMC alto sobre la salud, encontraron que el exceso de peso corporal lleva a 4 millones de muertes y a 120 millones de años de vida ajustados por discapacidad en todo el mundo en 2015. Cerca del 70% de las muertes relacionadas al alto IMC se debieron a enfermedad cardiovascular, y más del 60% de esas muertes ocurrieron entre personas obesas. La prevalencia de obesidad aumentó durante las últimas tres décadas y a un ritmo más rápido que la carga de enfermedad relacionada. Sin embargo, tanto la tendencia como la magnitud de la carga de enfermedad relacionada con el IMC varían ampliamente entre los países.
Entre los principales riesgos para la salud que fueron evaluados en el estudio de Carga Global de Enfermedad 2015, el IMC alto continúa teniendo una de las tasas más altas de crecimiento. A través de los niveles de desarrollo, la prevalencia de la obesidad ha aumentado en las últimas décadas, lo que indica que el problema no es simplemente una función del ingreso o de la riqueza.13
| Los cambios en el entorno alimentario y en los sistemas alimentarios son probablemente los principales impulsores.18 La mayor disponibilidad, accesibilidad y asequibilidad de alimentos densos en energía, junto con la intensa comercialización de alimentos, podría explicar el exceso de ingesta de energía y el aumento de peso entre diferentes poblaciones.18 La reducción de las oportunidades de actividad física que siguieron a la urbanización y otros cambios en el entorno construido también se consideraron como posibles conductores; sin embargo, estos cambios generalmente precedieron al aumento global de la obesidad y es menos probable que sean los principales contribuyentes.18 |
Durante la última década, los investigadores propusieron una gama de intervenciones para reducir la obesidad.19 Entre tales intervenciones están la restricción de la publicidad de alimentos no saludables para los niños, aumentando las comidas escolares, utilizando los impuestos para reducir el consumo de alimentos poco saludables y proporcionar subsidios para aumentar la ingesta de alimentos saludables, y utilizar incentivos en la cadena de suministro para aumentar la producción de alimentos sanos.19 Sin embargo, la efectividad, la viabilidad de una aplicación generalizada, y la sostenibilidad de tales intervenciones necesitan ser evaluadas en diversos entornos.
En años recientes, algunos países han empezado a implementar estas políticas,1 pero no se demostró mayor éxito en la población. Muchos de los países con los mayores incrementos en la prevalencia de obesidad son aquellos que tienen un ISD bajo o medio y que simultáneamente tienen altas tasas de otras formas de desnutrición. Estos países suelen tener recursos financieros limitados para programas de nutrición y dependen principalmente de donantes externos cuyos programas a menudo se centran preferentemente en la desnutrición; en consecuencia, la seguridad alimentaria frecuentemente tiene prioridad sobre la obesidad en estos países.20
En 2013, la Organización Mundial de la Salud (OMS) hizo un llamado para el aumento cero de la prevalencia de sobrepeso entre los niños y de la prevalencia de obesidad en los adultos.21 Sin embargo, dado el ritmo actual de aumento y los desafíos existentes en la implementación de políticas alimentarias, el logro de este objetivo es poco probable en un futuro próximo.
El estudio de los autores mostró un mayor aumento en la tasa de exposición al IMC elevado que en la tasa de la carga de la enfermedad relacionada. Esta diferencia fue impulsada principalmente por la disminución de la mortalidad eliminada por riesgo, particularmente para enfermedades cardiovasculares; factores como un mejor tratamiento o cambios en los otros riesgos se tradujeron en una disminución de la tasa de enfermedad cardiovascular a pesar del aumento del IMC.
Las políticas existentes basadas en la evidencia, aunque se apliquen plenamente, es poco probable que reduzcan rápidamente la prevalencia de obesidad. Las intervenciones clínicas, sin embargo, demostraron ser eficaces en el control de los niveles de presión arterial sistólica, colesterol y glucosa en plasma en ayunas - los principales factores de riesgo de la enfermedad cardiovascular.22
El uso extendido de esas intervenciones entre personas con sobrepeso y obesas podría reducir eficazmente la carga de enfermedad relacionada con el alto IMC. Un análisis de cohorte reciente de 1,8 millones de participantes mostró que casi la mitad del exceso de riesgo de enfermedades isquémicas del corazón y más del 75% del exceso de riesgo de accidente cerebrovascular que estaba relacionado con el IMC se midió a través de una combinación de aumento de los niveles de presión arterial, colesterol sérico total, y glucemia en ayunas.23
Juntos, estos hallazgos sugieren que las intervenciones clínicas para reducir la tasa subyacente de enfermedad podría reducir sustancialmente la carga enfermedad relacionada con el alto IMC, aunque un peso corporal normal sigue siendo necesario para lograr el máximo beneficio.
A nivel mundial, el 39% de las muertes y el 37% de los años de vida ajustados por discapacidad que estaban relacionados con un alto IMC ocurrieron entre personas no obesas. A pesar de que algunos estudios sugirieron que el sobrepeso está asociado con un menor riesgo de muerte por cualquier causa como un rango normal de IMC (18 a 25),2,10 la evidencia reciente de un metanálisis14 y análisis9de grupo de los estudios observacionales prospectivos mostró un incremento continuo en el riesgo de muerte asociada con un IMC de más de 25.
El mínimo nivel de riesgo propuesto por los autores de 20 a 25 para el IMC
Estos estudios son particularmente notables ya que notifican mayores fuentes de sesgo en los estudios previos (es decir, la confusión residual debida al fumar y la causalidad inversa debido a la preexistencia de enfermedad crónica) restringiendo el análisis a personas que nunca habían fumado y que no habían fumado y que no tenían enfermedades crónicas. Además, el análisis de cohorte controlado por el mismo conjunto de covariables, proporcionó riesgos relativos de causa específica, y evaluó la relación entre el IMC y la mortalidad en diferentes regiones.
El balance de la evidencia entonces apoya el mínimo nivel de riesgo propuesto por los autores de 20 a 25 para el IMC. Al mismo tiempo, hasta la fecha, sigue habiendo pruebas insuficientes para apoyar el argumento de que el nivel más beneficioso de IMC debe variar según la ubicación geográfica o el grupo étnico9 debido a las diferencias en la relación entre el IMC y la distribución de la grasa corporal.
Los autores encontraron que el 5% de los años de vida ajustados por discapacidad relacionados con un alto IMC fueron por trastornos musculoesqueléticos. Aunque el IMC alto es un importante factor de riesgo que contribuye a los años vividos con discapacidad a nivel mundial, y los costos asociados con el tratamiento son sustanciales,24 estos resultados de salud no mortales pero debilitantes recibieron relativamente poca atención política.
La pérdida de peso es beneficiosa en la prevención y tratamiento del dolor musculoesquelético.25 Una combinación de una modesta pérdida de peso y un ejercicio moderado proporciona una mejoría general del dolor musculo esquelético mejor que cualquier intervención sola26; sin embargo, las intervenciones quirúrgicas pueden ser más efectivas para los obesos mórbidos.27
La evaluación sistemática por parte de los autores de los estudios observacionales prospectivos mostró evidencia suficiente para apoyar una relación causal entre IMC y cánceres de esófago, colon y recto, hígado, vesícula biliar y vía biliar, páncreas, mama, útero, ovario, riñón y tiroides, junto con leucemia.
Una revisión reciente de la Agencia para la Investigación del Cáncer (AIC)4 llegó a conclusiones en gran parte similares, excepto respecto a la leucemia. (Los autores incluyeron leucemia en la base de una revisión sistemática y metanálisis de 21 estudios prospectivos de cohortes.28) Además, aunque el informe de la AIC reconoció asociaciones inversas consistentes entre el IMC y el riesgo de cáncer de mama premenopáusico, hallazgos inconsistentes de los estudios que evaluaron el efecto de la circunferencia de la cintura o del peso corporal llevaron a la exclusión del cáncer de mama premenopáusico de su lista.
Sin embargo, el IMC fue la exposición de interés en el análisis de los autores, incluyeron el efecto protector del alto IMC en el cáncer de mama en mujeres premenopáusicas. No evaluaron el efecto del alto IMC en el cáncer gástrico (cardia) y en el meningioma debido a la falta de datos suficientes para estimar por separado incidencia y mortalidad de estos cánceres a nivel de la población.
El estudio de los autores tiene varias fortalezas importantes. Abordaron las principales limitaciones de los estudios previos, incluyendo más fuentes de datos y cuantificando la prevalencia de obesidad entre los niños. También evaluaron sistemáticamente la fuerza de la evidencia de la relación causal entre el alto IMC y los resultados en salud e incluyeron todos los pares de IMC-resultado para los que hubiera suficiente evidencia con respecto a la relación causal.
Utilizaron una distribución beta para caracterizar la distribución del IMC a nivel de la población, método que captura la proporción de la población con mayor IMC con mayor precisión que otras distribuciones.12 Utilizaron la mejor evidencia disponible para determinar el IMC de riesgo más bajo. Cuantificaron las tendencias del alto IMC y los factores asociados de carga de la enfermedad a través de los niveles de desarrollo y estimaron la contribución de la transición demográfica y de la transición epidemiológica a los cambios en la carga relacionados con el IMC.
Las limitaciones potenciales de este estudio también deberían considerarse. Los autores utilizaron tanto auto-reporte como datos medidos con respecto a la altura y el peso y corrigieron el sesgo en los datos autoinformados usando datos medidos en cada edad, sexo y área geográfica.
Para aplicar una definición coherente para el sobrepeso en la infancia y la obesidad entre las fuentes, usaron la definición del Grupo Internacional de Trabajo de Obesidad y excluyeron los estudios que utilizaron la definición de la OMS. No propagaron la incertidumbre en el patrón de edad y el patrón de sexo que se utilizaron para dividir los datos agregados. No incorporaron la incertidumbre de la regresión de los coeficientes de regresión del IMC en su análisis.
Los datos fueron escasos para algunos lugares, particularmente en los primeros años, y las estimaciones en estos lugares se basaron en covariables a nivel de país y en datos regionales. No identificaron un patrón consistente en la relación entre los datos nacionales representativos y los datos que representan sólo áreas urbanas o rurales y no fue posible corregir esos datos por el sesgo potencial. No evaluaron las tendencias en otras medidas de adiposidad que se pueden relacionar mejor con resultados específicos de salud, incluyendo la circunferencia de la cintura y la relación cintura-cadera.
Debido a que los autores obtuvieron el tamaño del efecto del IMC sobre los resultados de salud a partir de estudios observacionales prospectivos, la posibilidad de confundir con los hábitos de estilo de vida no puede excluirse. La estimación de los riesgos relativos no captó las posibles diferencias debido a un grupo étnico y no explicó la posibilidad de la variación geográfica en las curvas de riesgo relativo o en el IMC de riesgo más bajo. Además, estos estudios generalmente excluyeron a las personas con enfermedades crónicas prevalentes a partir del análisis de la estimación del riesgo relativo.
Por lo tanto, las estimaciones de los autores representan el efecto del IMC entre las personas sin enfermedades subyacentes. Esta cuestión puede ser particularmente importante para los grupos de edad avanzada, en los que la enfermedad crónica aumenta. Finalmente, otras probables complicaciones o formas de carga (por ejemplo, la carga de la enfermedad en los niños) no estén incluidas.
En conclusión, el estudio de los autores proporciona una evaluación de las tendencias del IMC elevado y de la carga de enfermedad asociada. Los resultados muestran que tanto la prevalencia como la carga de morbilidad del alto IMC están aumentando globalmente. Estas conclusiones ponen de relieve la necesidad de intervenciones multicomponentes para reducir la prevalencia y la carga de la enfermedad del alto IMC.
⇒ Comentario
El sobrepeso y la obesidad aumentaron su prevalencia tanto en adultos como en niños en los últimos años siendo un problema de salud pública cada vez más relevante. El presente estudio determina que la carga de enfermedad relacionada con el alto IMC se incrementó desde 1990, con más de dos tercios de las muertes en personas con alto IMC debidas a enfermedad cardiovascular. Se remarca la necesidad de la vigilancia del IMC, y de la implementación y evaluación de intervenciones basadas en la evidencia para el control de esta problemática.
Resumen y comentario objetivo: Dra. Alejandra Coarasa